PDCO – News | Beitrag aus pharmind 88 | Nr. 2 | Seite XXVII-XXXI (2026)
11.03.2026Der Ausschuss für Kinderarzneimittel (Paediatric Committee, PDCO) ist ein wissenschaftliches Gremium der EMA, das die eingereichten pädiatrischen Prüfkonzepte (Paediatric Investigation Plan, PIP) ...
Pharma Deutschland reicht Stellungnahme zum EU Biotech Act I ein
11.03.2026In seiner Stellungnahme begrüßt Pharma Deutschland ausdrücklich, dass der Biotech Act die Gesundheitsbiotechnologie als strategisches Zukunftsfeld in den Mittelpunkt rückt. Aus Sicht des ...
BioNTech und Mitgründer kündigen Pläne für neues Mitgründer-geführtes Unternehmen zur Entwicklung von mRNA-Innovationen der nächsten Generation an
11.03.2026BioNTech SE gab Pläne für ein eigenständiges neues Unternehmen bekannt, das von den BioNTech-Mitgründern Prof. Dr. Ugur Sahin und Prof. Dr. Özlem Türeci gegründet und geleitet werden soll. Das ...
Lonza und Genetix Biotherapeutics verlängern die Vereinbarung zur kommerziellen Herstellung von ZYNTEGLO™
11.03.2026Lonza, eines der weltweit größten Auftragsentwicklungs- und Produktionsunternehmen (CDMOs), und Genetix Biotherapeutics Inc. (Genetix), ein Biotechnologieunternehmen in der ...
Copa-Data und Pavis Engineering starten strategische Partnerschaft für industrielle Digitalisierung
11.03.2026Der Automatisierungssoftware-Anbieter Copa-Data und der Integrationsspezialist Pavis Engineering arbeiten künftig enger zusammen. Ziel der Partnerschaft ist es, Industrieunternehmen bei der ...
Roland Fornika zum Präsidenten der FECCIA gewählt
11.03.2026VAA-Vorstandsmitglied Dr. Roland Fornika ist zum Präsidenten der FECCIA gewählt worden. Bei der FECCIA-Präsidiumstagung im Rahmen der JusTransLEAD-Konferenz in Malaga sprach sich das Gremium für ...
Peter Strohschneider wird Forschungskurator der Leopoldina
11.03.2026Peter Strohschneider, Mediävist, ehemaliger Präsident der Deutschen Forschungsgemeinschaft DFG und ehemaliger Vorsitzender des Wissenschaftsrats, ist seit März Forschungskurator der Nationalen ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
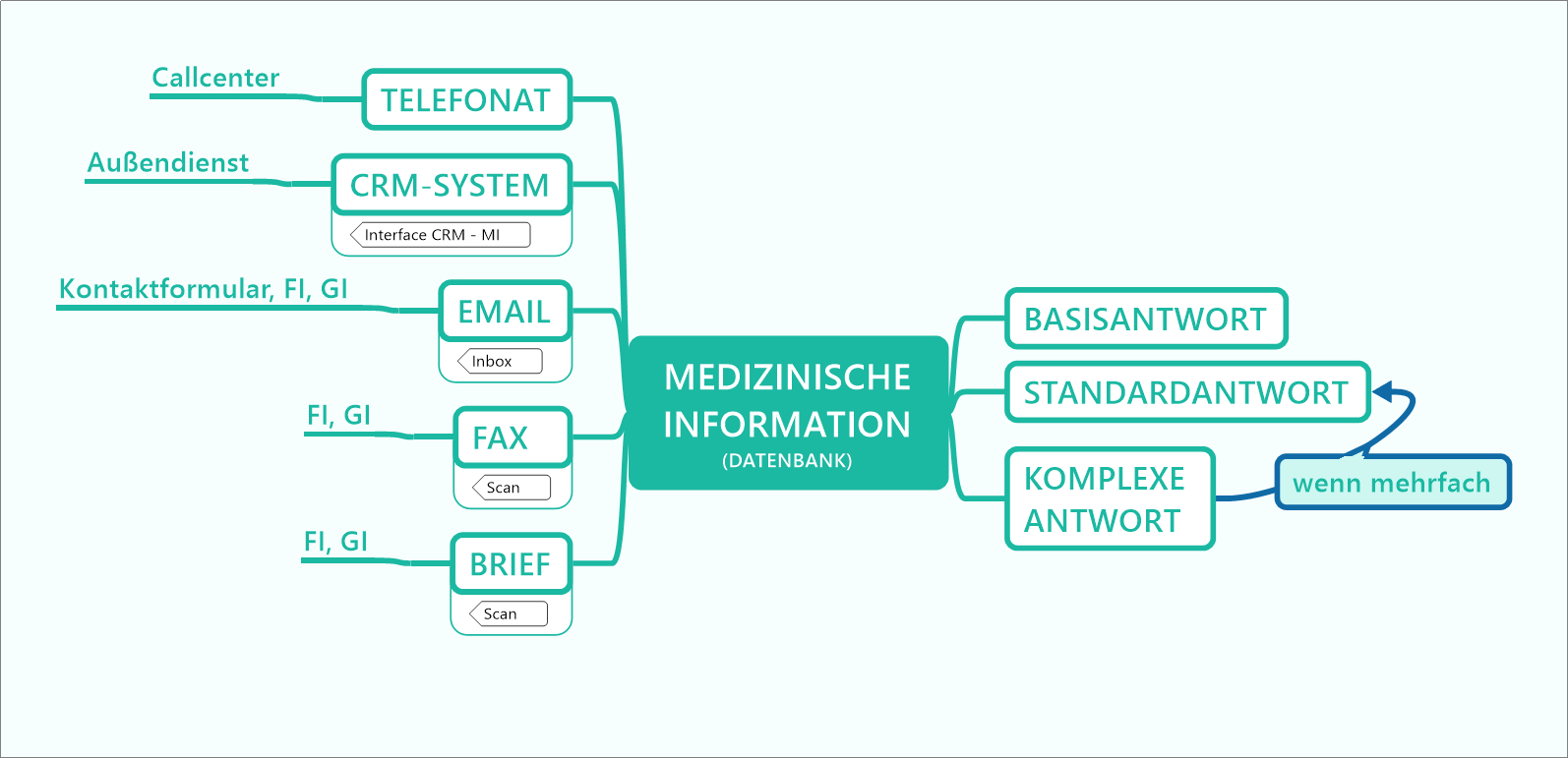
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.