Implementierung der DPTE-Port-Technologie zur Stopfeneinbringung bei einer Vial-Abfüllanlage
Maschinen- und Anlagenbau
Key Words Sterilproduktion | Stopfenzuführung | RABS | DPTE port | State of the Art
Zusammenfassung
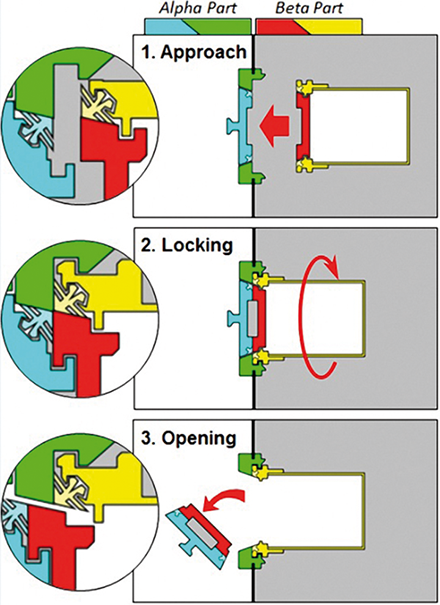
Im Rahmen eines Optimierungsprojekts zum Upgrade einer Vial-Abfüllanlage wurde neben dem Umrüsten der Anlage auf eine RABS-Linie (restricted access barrier system) auch die Zulieferung der Gummistopfen auf die Linie auf Port-Technologie umgestellt. Zusätzlich zur Implementierung eines entsprechenden Alpha-Ports und einer Stopfenzuführung an der Linie musste auch ein zusätzlicher Umverpackungsschritt für die verwendeten Gummistopfen in RTS-Qualität (ready to sterilize) realisiert werden. Dazu wurde im Produktionsbereich in Zone C / ISO 7 eine LF-Bank (laminar flow) implementiert. Damit besteht die Möglichkeit eines partikelfreien Umfüllprozesses von Stopfen in RTS-Qualität aus ihrer Originalverpackung in Tyvek®-Beutel mit angeschweißtem β-Port. Für einen möglichst partikelfreien Prozess wurde die LF-Bank mit verschiebbaren Scheiben aus Polycarbonat versehen, die zusätzlich mit Ports zur Fixierung von Eingriffshandschuhen ausgestattet wurden. Im Rahmen des Projekts wurden alle betroffenen Prozessschritte neu qualifiziert. Neben der Prozessvalidierung des neuen Transferprozesses (kein aseptisches Risiko für den Stopfentransfer) mussten die Sterilisation im Dampfautoklav (geändertes Beladeschema), der neue Umfüllprozess (kein negativer Einfluss auf die Primärpackmittel), die ß-Port-Beutel als neues Prozessmaterial sowie die Funktionalität der LF-Bank (Partikelabreicherung und Laminar-Flow-Strömung) bewertet und qualifiziert werden. Für die Dokumentation des neuen Prozessschritts „Stopfen Umpacken“ wurde eine neue Herstellvorschrift erstellt, die im bestehenden MES-System (manufacturing execution system) als eBR (electonic batch record) abgearbeitet werden kann. Zudem gewährleistet sie die lückenlose Dokumentation der Prozesse und die Nachverfolgbarkeit der eingesetzten Primärpackmittel.
Korrespondenz:
Tobias Schlögl, Biopharma Operations, Boehringer Ingelheim Pharma GmbH & Co. KG, Birkendorfer Str. 65, 88400 Biberach an der Riß; e-mail: tobias.schloegl@boehringer-ingelheim.com
 | Tobias Schlögl Tobias Schlögl begann seine berufliche Laufbahn 2007 bei Vetter Pharma in der Qualitätssicherung. Dort war er u. a. zuständig für Abweichungs- und Change-Management. Nach internem Wechsel in die aseptische Produktion als Teammanager war er verantwortlich für den GMP-Betrieb mehrerer Reinräume. 2011 wechselte Schlögl zu Boehringer Ingelheim und ist dort als Herstellungsleiter |
Sie haben Tech4Pharma / cleanroom & processes für sich entdeckt und möchten auf alle Beiträge und Ausgaben Zugriff haben?
Dann registrieren Sie sich noch heute kostenlos und genießen Sie sofort alle Möglichkeiten – recherchieren, lesen, downloaden.