Im Spannungsfeld zwischen GMP und Biosicherheit
Die Biosicherheit in der pharmazeutischen Industrie
Regularien
Zusammenfassung
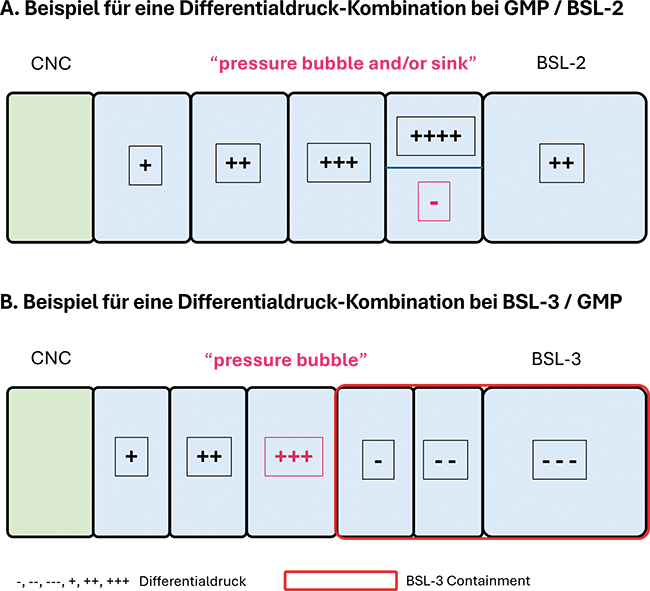
Während bei der biotechnologischen Entwicklung und Produktion der meisten pharmazeutischen Wirkstoffe prinzipiell die Biosicherheitsmaßnahmen auf das Vermeiden einer Freisetzung genetisch modifizierter Organismen (GMO) und artifizieller Sequenzen und einem generellen Personenschutz abzielen (Biosicherheitsstufe 1, BSL-1), ergeben sich bei der Arbeit mit Krankheitserregern oder GMOs, die hochaktive Wirkstoffe oder Toxine exprimieren, deutlich komplexere Anforderungen (BSL-2, BSL-3). Hier gilt es einerseits die Mitarbeitenden effizient zu schützen und andererseits die Kontamination, Verschleppung und Freisetzung von Krankheitserregern und GMOs zum Schutz der Bevölkerung, der Umwelt und der landwirtschaftlichen Betriebe zu verhindern. Diese Anforderungen können bei gleichzeitiger Einhaltung der guten Herstellungspraxis (GMP) nicht nur zusätzliche Maßnahmen erfordern, sondern gerade bei der baulich-technischen Konzeption auf den ersten Blick schwer umsetzbar erscheinen. Unter Berücksichtigung der jeweils vorliegenden anlagen- und projektspezifischen Risiken gibt es aber Lösungswege.1)
Korrespondenz:
Gesche Bernhard
Basler & Hofmann AG, Bachweg 1, CH-8133 Esslingen
gesche.bernhard@baslerhofmann.ch
 | Dr. Gesche Bernhard ist Projektleiterin Biosicherheit (Basler & Hofmann AG) und Lead Auditor für ISO 35001 Biorisk Management Systeme. Sie überprüft und berät weltweit die Designentwicklung und den Betrieb von BSL-1 bis (A)BSL-4 Laboren und Produktionsanlagen, inkl. GAPIV. Gemäß dem Motto „Aus der Praxis für die Praxis“ bringt sie dabei ihre langjährigen Erfahrungen in der biomedizinischen Grundlagenforschung, Innovationsentwicklung, pharmazeutischen Industrie |
Schließen Sie hier ein Abonnement ab und profitieren Sie von den vielseitigen Nutzungsmöglichkeiten.