CVMP – News | Beitrag aus pharmind 88 | Nr. 2 | Seite IX-XIV (2026)
06.03.2026Der Wissenschaftliche Ausschuss für Tierarzneimittel (Committee for Veterinary Medicinal Products, CVMP) tagt monatlich bei der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA) in ...
Industrial Accelerator Act (IAA) – Industry first: wichtiger denn je
06.03.2026Die Europäische Kommission hat den „Industrial Accelerator Act“ (IAA) vorgestellt. Ziel ist es, Europas Industrie widerstandsfähiger und wettbewerbsfähiger zu machen. Der VCI sieht darin ...
BPI: 10-Punkte-Plan für Krisenzeiten
05.03.2026Die militärische Eskalation im Nahen Osten kann zu einer weiteren Gefahr für die Arzneimittelversorgung Europas werden, warnt der Bundesverband der Pharmazeutischen Industrie (BPI). „Wir sind in ...
Apothekenreform: Großhandel stärken und Kontrolle der Versender gesetzlich regeln
06.03.2026Im Deutschen Bundestag fand an diesem Mittwoch eine öffentliche Anhörung zur Apothekenreform (ApoVWG) statt. In seiner Stellungnahme fordert der Bundesverband PHAGRO eine Stärkung des ...
Phagro – Stellungnahme zum Gesetzentwurf der Bundesregierung – Entwurf eines Gesetzes zur Weiterentwicklung der Apothekenversorgung
06.03.2026Der PHAGRO | Bundesverband des pharmazeutischen Großhandels e. V. bedankt sich für die Möglichkeit zur Stellungnahme zum Entwurf der Bundesregierung eines Gesetzes zur Weiterentwicklung der ...
AMW: Pharma-Spezialist aus Bayern gewinnt internationale Investoren für Drug-Delivery-Technologien
06.03.2026Die AMW GmbH, ein Spezial-Pharmaunternehmen mit Fokus auf biologisch abbaubare Drug-Delivery-Systeme, hat einen Wechsel in seiner Gesellschafterstruktur bekannt gegeben. Neue Mehrheitseigentümer ...
Daiichi Sankyo Europe und GAIA kooperieren zur Einführung von lipodia
06.03.2026Daiichi Sankyo Europe, ein seit Jahrzehnten in der kardiovaskulären Prävention und Therapie engagiertes Unternehmen mit breiter klinischer Erfahrung und internationaler Studienbasis, und GAIA, ...
KI-Biologieunternehmen sichert sich 25 Millionen US-Dollar für virtuelle Zellmodelle
06.03.2026Turbine kündigte eine Serie-B-Finanzierung in Höhe von 25 Millionen US-Dollar, eine branchenübergreifende Ausweitung seiner Plattform für virtuelle Zellen und eine neue, auf die Immunologie ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
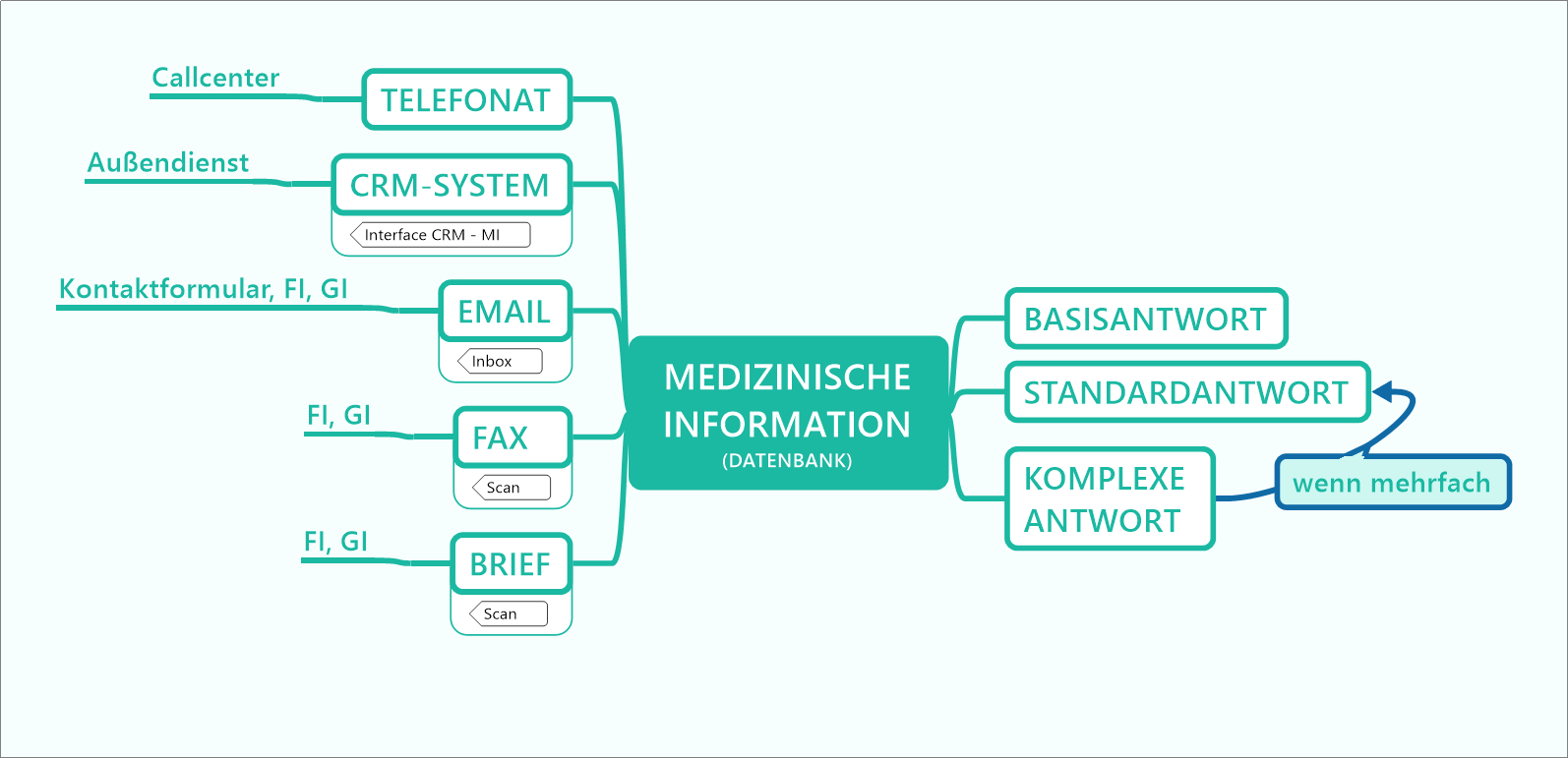
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.