Extrem resistent | Beitrag aus cleanroom & processes 4 | Nr. 4 | 214-215 (2025)
03.03.2026Robuste Bakterien in NASA-Reinräumen? Das ist mittlerweile nichts Neues. Eine Studie amerikanischer Wissenschaftler zeigt nun jedoch, wie widerstandsfähig die Mikroben auch gegenüber simulierten ...
FiT2clean Award 2026 – Bewerbungsphase gestartet
06.03.2026Die Bewerbungsphase für den 5. FiT2clean Award des Fachverbands industrielle Teilereinigung e. V. (FiT) hat begonnen. Hersteller, Anbieter und Anwender aus allen Segmenten der industriellen ...
Bausch+Lomb erweitert sterile Produktion mit neuer Abfülllinie von Steriline
11.03.2026Der Augenheilkunde-Spezialist Bausch+Lomb investiert in moderne Produktionsanlagen für sterile ophthalmologische Produkte. Am italienischen Standort Macherio hat das Unternehmen eine neue Abfüll- ...
Siemens erweitert Portfolio für halbleiterbasierte Schutzschaltgeräte und bringt zirkulären Sanftstarter auf den Markt
06.03.2026Siemens Smart Infrastructure stellt wichtige Fortentwicklungen seines Portfolios industrieller Steuer- und Schutzgeräte vor. Das Unternehmen erweitert die Funktionen seines halbleiterbasierten ...
EU GMP Annex 1 treibt Modernisierung voran: Inibsa setzt auf Syntegon für RABS-Upgrade
03.03.2026Die Einhaltung von EU GMP Annex 1 stellt derzeit eine der größten Herausforderungen für Pharmahersteller und Lohnabfüller dar. Das gilt auch für Inibsa, einen weltweit führenden Anbieter von ...
Roboter für Food- und Pharma-Packaging
11.03.2026Auf der Interpack unterstreicht Stäubli auf Stand C38 der Halle 15 seine Kompetenz im Bereich Food- und Pharma-Packaging mit wegweisenden Innovationen. Dabei hat der Hersteller sein Portfolio an ...
meistgelesen
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
Im Spannungsfeld zwischen GMP und Biosicherheit
Die Biosicherheit in der pharmazeutischen Industrie
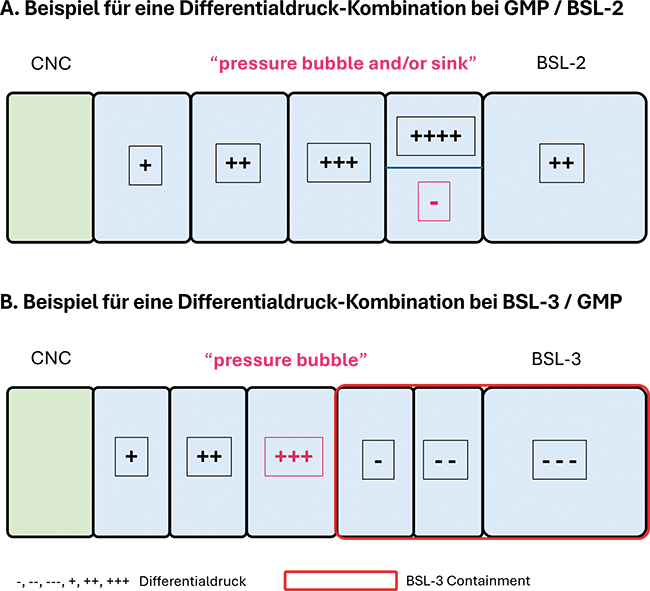
Im Rahmen der guten Herstellungspraxis (GMP) stehen hohe Anforderungen an den Produktschutz im Vordergrund. Dadurch fallen bei Biosicherheitsstufe 1 (BSL-1) die generellen Biosicherheitsmaßnahmen während des Produktionsprozesses trotz unterschiedlicher Zielsetzung kaum ins Gewicht. Sie lassen sich meist einfach umsetzen und sind oft durch GMP-Maßnahmen mit abgedeckt.Die Herausforderungen der Biosicherheit auf der Stufe BSL-1 liegen in ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
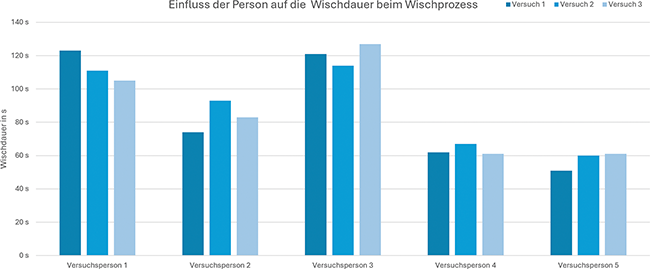
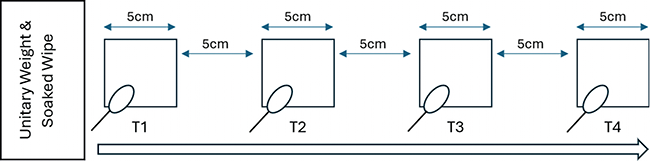
Reinigungseffizienz und Qualitätskonstanz
Entwicklung und Einsatz eines intelligenten Wischmopphalters für optimierte Reinraum-Wischprozesse
Reinräume und die betriebliche Umsetzung der Kontaminationskontrolle in diesen Räumen sind grundlegende Voraussetzungen für Branchen mit hohen Anforderungen an Hygiene und Sauberkeit wie in der Pharmazie, Medizintechnik, Biotechnologie, Mikroelektronik oder in der Lebensmittelindustrie. Durch die Coronakrise stiegen die Anforderungen insbesondere in der Pharmazie und im Gesundheitswesen nochmals an. In der Pharmaindustrie wurden zudem die ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
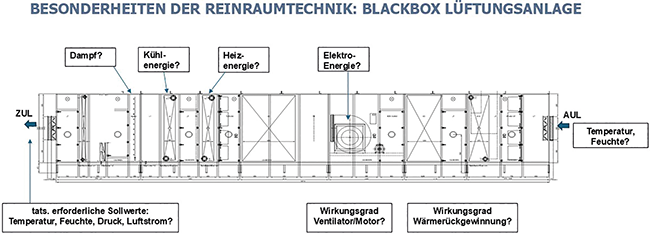
Energieeffizienz in der Reinraumtechnik
Die neue Richtlinie VDI 2083-4.2
Die Reinraumtechnik ist besonders energieintensiv. Zur Schaffung von kontrollierten Umgebungsbedingungen wie Partikelkonzentration, Temperatur, Feuchte und Druck sind oft große Luftmengen in hoher Aufbereitungsqualität erforderlich. Entsprechend hoch ist der Energiebedarf von Reinräumen.Die Energiebedarfe von reinraumtechnischen Anlagen überschreiten diejenigen von Wohn- und Verwaltungsgebäuden um ein Vielfaches. Während jedoch bei Wohn- und ...
Top Themen
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
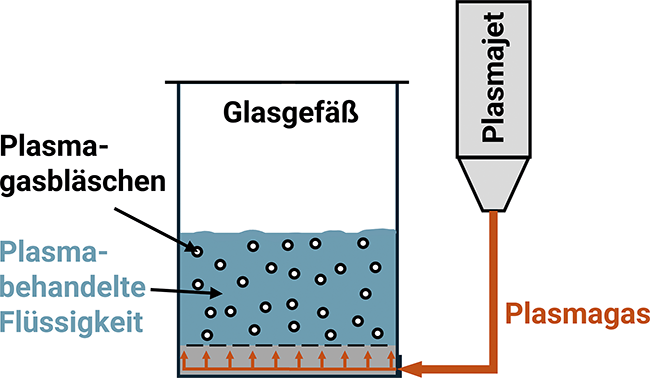
Plasmabehandelte Flüssigkeiten
Hygienische Reinigung anspruchsvoller Bauteile und Oberflächen
Reinräume sind speziell kontrollierte Umgebungen für die Entwicklung und Herstellung hochsensibler Produkte. Die Reinraumumgebung ermöglicht die Einhaltung regulatorischer Anforderungen und effiziente Herstellungsprozesse. Durch den Reinraum werden Umgebungsbedingungen geschaffen, indem das Kontaminationsrisiko für Produkte durch Prozesse und Produktlogistik minimiert wird. Entscheidende Bedeutung haben Reinräume in Branchen wie der ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 01/2026 der Zeitschrift cleanroom & processes
(erscheint am 17.03.2026)
Richtiges Ankleiden und Verhalten im Reinraum – Ein Schlüssel für die Produktqualität
Der Mensch stellt im Reinraum die größte Kontaminationsquelle in sensiblen Branchen wie Pharma-, Halbleiter- oder Medizintechnikproduktion dar. Geschulte Mitarbeiter tragen täglich eine große Verantwortung für die Einhaltung der richtigen Ankleideprozedur sowie für das korrekte Verhalten im Reinraum. Ein geeignetes Bekleidungskonzept kann über Messungen der Partikelwerte mittels Body Box erfasst werden und stellt die Grundlage für eine mögliche Leistungsqualifizierung dar.
Neben dem korrekten Ankleiden ist das richtige Verhalten von enormer Bedeutung, um Risiken zu minimieren. Durch regelmäßige Schulungen, klare Verfahrensanweisungen und dem konsequenten Streben nach Verbesserungen kann dauerhaft eine qualitativ hochwertige Produktion sichergestellt werden.