Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-

Industriesauger
Rubrik: Produkte
(Treffer aus cleanroom & processes, Nr. 03, Seite 170 (2024))
Industriesauger / Produkte
Nilfisk hat die Mini-Industriesauger VHS010 und VHS011 vorgestellt. Die kompakten Sicherheitssauger bieten hohe Saugleistung und Sicherheit am Arbeitsplatz. Mit einer Höhe von maximal 830 mm und einem Gewicht von bis zu 21 kg sind sie leicht transportierbar und erreichen schwer zugängliche Bereiche. Der bürstenlose Bypass-Motor (VHS011) liefert bis zu 950 Watt Leistung. Der maximale Luftstrom beträgt bis 3 466 l/min bei einem Unterdruck von bis zu 210 mbar. So ist selbst das Absaugen schwerer Metall- und Kunststoffrückstände möglich. Die Sauger sind für explosionsgefährdete (ATEX22) und nicht-explosionsgefährdete Bereiche geeignet und verfügen über H14-Filter (VHS010) oder M-Klasse-Patronenfilter (VHS011). Das Safe-Bag-System und der Edelstahlbehälter (VHS011) gewährleisten ... -

Reinraumförderbänder
Rubrik: Produkte
(Treffer aus cleanroom & processes, Nr. 03, Seite 170 (2024))
Reinraumförderbänder / Produkte
Die Montech AG bringt die neue Reinraumförderband-Linie TB30R/TB40R auf den Markt. Die speziell entwickelten Förderbänder sind für den Reinraum der ISO-Luftreinheitsklassen 4, 5 und 6 geprüft und zertifiziert. Die zertifizierten Förderbänder dienen als Zu- und Wegführbänder in einzelnen Fertigungsanlagen oder zur Verkettung kompletter Produktionsprozesse, z. B. für die Intralogistik von Kathetern, Spritzen, Liquid-Handling, Mikroprozessoren oder optischen Komponenten. Ihre Gurte verfügen nicht nur über Reinraumtauglichkeit, sondern sind auch von der FDA zugelassen. Dank der modularen Bauweise können die Förderbänder individuell konfiguriert und jederzeit einfach sowie kostengünstig verlängert oder verkürzt werden. Auf Basis der 3 vom Fraunhofer IPA getesteten und zertifizierten Förderbänder (TB40R-400x1500/VR, TB30R-140x1500/VR, TB30R-140x1500/MR) ... -

Schraubengebläse
Rubrik: Produkte
(Treffer aus cleanroom & processes, Nr. 03, Seite 170 (2024))
Schraubengebläse / Produkte
Aerzen stellt die neuen, direkt angetriebenen Delta-Hybrid-Baugrößen vor, die technologische Weiterentwicklung der Aerzen Schraubengebläse-Baureihe. Sie verfügen über ein 3+4-Rotoprofil und können optional mit IE5-Motoren ausgerüstet werden. Die neuen Baugrößen sind modular und können wegen des großen Volumenstromregelbereichs in nahezu jeder Anwendung zur ölfreien Luftverdichtung – fix oder variabel – bis zu 1 250 mbarg eingesetzt werden. Die Geräte sind TÜV-zertifiziert ölfrei nach Klasse ISO 8573-1. Sie haben keine Beschichtung der Schraubenrotoren und es besteht die Möglichkeit, einen reaktiven Schalldämpfer ohne Absorptionsmaterial einzusetzen. Die neuen Delta-Hybrid-Baugrößen können weltweit installiert werden: bei extremen Umgebungstemperaturen von -40 °C–50 °C, aber auch mit dem optionalen Außenschutz unter direkter atmosphärischer ... -

45 Jahre Dastex Reinraumzubehör GmbH & Co. KG
Rubrik: Partner der Industrie
(Treffer aus cleanroom & processes, Nr. 03, Seite 169 (2024))
45 Jahre Dastex Reinraumzubehör GmbH & Co. KG / Partner der Industrie
Was haben ein Satellit, ein Mikrochip und ein Medikament gemeinsam? Vermutlich wurde bei mindestens einem Prozessschritt Reinraumbekleidung aus dem Hause Dastex getragen. Dastex wurde 1979 von Ingo Moschner gegründet ( Abb. 1 ). DasTex(til) oder gesprochen „d/a/stEx“ für „Dust/Staub weg“, beides denkbare Varianten der Namensfindung. Als eines der ersten Unternehmen in Europa fertigte Dastex auf Kundenwünsche zugeschnittene Mehrwegreinraubekleidung an. Im Jahre 1992 stieg Carsten Moschner in das Familienunternehmen ein und baute es zu einem der führenden Anbieter für Reinraumverbrauchsgüter in Europa aus. Das Produktportfolio wurde kontinuierlich mit dem Ziel erweitert, den hohen Qualitätsansprüchen und den steigenden Prozessanforderungen gerecht zu werden. Langjährige Kundenbeziehungen, teils ... -

50 Jahre Rodinger Kunststoff-Technik GmbH
Rubrik: Partner der Industrie
(Treffer aus cleanroom & processes, Nr. 03, Seite 168 (2024))
50 Jahre Rodinger Kunststoff-Technik GmbH / Partner der Industrie
Am 1. Juli 1974 begann die Rodinger Kunststoff-Technik (RKT) GmbH als Produzent von Spritzgusswerkzeugen die Geschäftstätigkeit. Dies führte bald zum neuen Standbein, dem Kunststoffspritzguss und der Produktion von Kunststoffbauteilen für verschiedene Industriezweige. Nachhaltig beeinflusst wurde die Unternehmensentwicklung durch die Entscheidung, Bauteile für den Medizinsektor zu fertigen. Diese Branchenerweiterung liegt bereits über 25 Jahre zurück und ist einen näheren Blick in die Unternehmensgeschichte wert. Die ersten Gehversuche in Richtung Medizintechnik waren Bauteile für die Gehäuse von Insulinpens. Der Einstieg in die strengen Regularien der Medizintechnik war bei dem Projekt eher sanft, da bei der Produktion noch keine hohen Hygienemaßstäbe gefragt waren. Es genügten Sauberkeitsanforderungen ... -
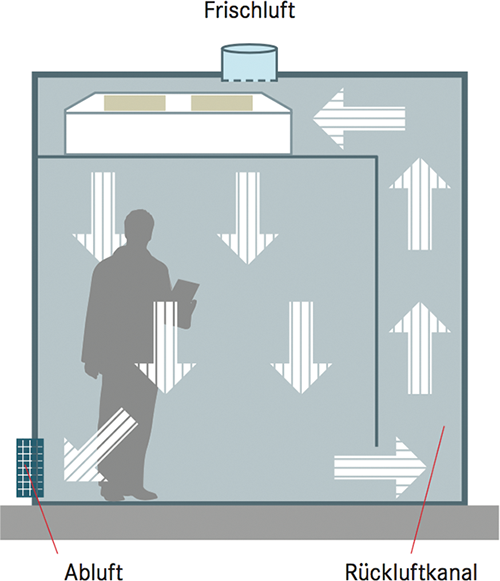
Reinraumkonzepte – das Wie und Warum?
Rubrik: Spektrum
(Treffer aus cleanroom & processes, Nr. 03, Seite 166 (2024))
Reinraumkonzepte – das Wie und Warum? / Spektrum
Schwebeteilchen (Staub- und Feinstaubpartikel, Keime, Aerosole oder andere Biopartikel) kommen überall in der Umgebungsluft und in Innenräumen vor und können wegen ihrer kleinen Abmessungen unter 10 μm lange in der Raumluft verweilen oder mit dem Luftstrom über große Entfernungen transportiert werden. Nicht nur für den Menschen ist Feinstaub schädlich und kann gesundheitliche Probleme verursachen, sondern auch mikroelektronische, medizinische oder pharmazeutische Produkte können in Mitleidenschaft gezogen werden. Feinstaubpartikel, die aus der Umgebungsluft stammen, lassen sich durch geeignete Luftströmungen und Luftfilteranlagen in den Griff bekommen. Aber die 2. Partikelquelle ist der Mensch selbst, denn er setzt eine sehr große Anzahl dieser Schwebeteilchen ... -
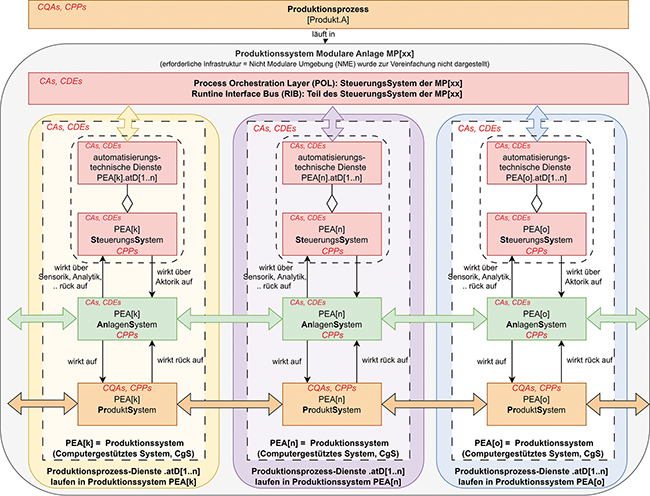
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 03, Seite 164 (2024))
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen / Teil 3.1*Teil 1 dieser Serie s. Tech4Pharma 2024; 14(1):18–25, Teil 2 s. Tech4Pharma 2024; 14(2):84–91. 1) z. B. computergestütztes System (CgS), Process Equipment Assembly (PEA), Functional Equipment Assembly (FEA), Komponenten (COMP), Modulare Anlage (MP) und Module Type Package (MTP), Process Orchestration Layer (POL) usw. 2) z. B. EU-GMP-Leitfaden Teil II, Anhänge 11 und 15, VDI 2776, VDI/VDE/NAMUR 2658 usw.: Erforderliche Schritte zum Beschaffen und Integrieren · Makait T · Thomas Makait QPRI – Transparenz für Projekteffizienz, Hofheim am Taunus
Modulare Anlagen Plug & Produce PEA, MTP, POL Qualifizierung Equipment Validierung computergestützter Systeme Im 1. Beitrag wurden die wesentlichen Schritte zur Flexibilisierung und Effizienzsteigerung in der pharmazeutischen Prozessindustrie durch das Beschaffen und Betreiben von vorqualifizierten Teilanlagen (PEAs) dargestellt. Es wurden erforderliche Schritte beschrieben, um dieses Potenzial zu heben und geeignete Vorgehensweisen zur abteilungs- und organisationsübergreifenden Zusammenarbeit zu etablieren. Im 2. Beitrag wurden die wesentlichen Anforderungen an eine integrierte Vorgehensweise zur Equipment-Qualifizierung und Validierung computergestützter Systeme für modulare Anlagen dargestellt. Im 4. Beitrag werden wesentliche Schritte zum Abschließen der Qualifizierung modularer (Gesamt-)Anlagen beschrieben, die aus vorqualifizierten PEAs für „Plug & Produce“ zusammengestellt werden. In ...
-

Das Salz im Getriebe – Neuer Prüfstand für Reinraumschmiermittel
(Treffer aus cleanroom & processes, Nr. 03, Seite 164 (2024))
Das Salz im Getriebe – Neuer Prüfstand für Reinraumschmiermittel / Fokus Forschung • Ionische Schmiermittel · Ludwig T
Forschende der Hochschule Mannheim suchen nach innovativen Schmiermitteln und entwickeln einen neuen Prüfstand für Reinraum- und Vakuumanwendungen. Es herrscht einige Aufregung in der Chemiebranche. Die Europäische Union plant ein Verbot per- und polyfluorierter Alkylsubstanzen (PFAS). Die sog. Ewigkeitschemikalien sind derzeit allgegenwärtig: in beschichteten Pfannen, Imprägniersprays, Kosmetik und Verpackungen. Doch auch die Industrie setzt auf die haftungsreduzierende und wasserabweisende Funktion der Moleküle, z. B. in Schmiermitteln. Eine besondere Rolle spielen einige Vertreter dieser Substanzgruppe in Reinräumen, in denen v. a. ihre niedrige Neigung zum Verdampfen und Ausgasen geschätzt wird. Das Problem: PFAS sind extrem beständig und reichern sich so in Gewässern ...
-
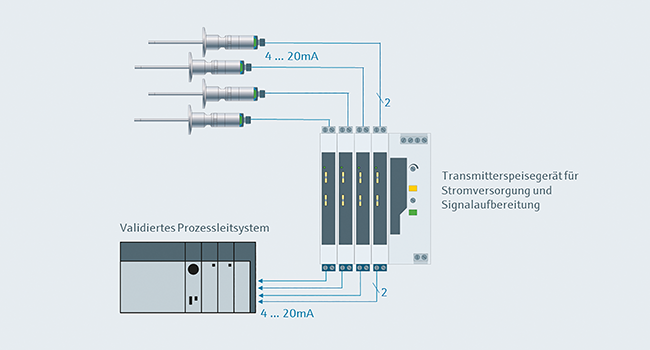
Integration digitaler Messgeräte in pharmazeutische Bestandsanlagen
Rubrik: Messen/Steuern/Regeln
(Treffer aus Tech4Pharma, Nr. 03, Seite 158 (2024))
Integration digitaler Messgeräte in pharmazeutische Bestandsanlagen / Vermeidung einer Neuvalidierung des Prozessleitsystems · Saecker D · Endress+Hauser Temperature+System Products, Nesselwang
Digitalisierung Risikominimierung Effizienzsteigerung Kontinuierliche Prozessvalidierung Die Zweileiter-Methode zur Übertragung eines kontinuierlichen Messwerts an das Prozessleitsystem ( Abb. 1 ) hat sich durchgesetzt und jahrzehntelang behauptet. Dabei wird der vom Sensor erfasste Messwert in ein 4…20-mA-Einheits-Stromsignal umgewandelt. 4 mA werden am Messbereichsanfang gesendet (z. B. 0 °C, 0 kg/h), 20 mA stehen an, wenn der vorgesehene Messbereich ausgeschöpft ist (z. B. 160 °C, 150 kg/h) [ 1 ]. Die Mehrzahl der Prozessmessinstrumente wird über die gleichen 2 Leiter versorgt, da 4 mA ausreichen, um die Elektronik in den Geräten zu betreiben. Um Störungen zu vermeiden, die durch unterschiedliche Erd-Potenziale hervorgerufen werden können, werden in vielen Anwendungen Transmitterspeisegeräte mit galvanischer Trennung eingesetzt. Diese ...
-
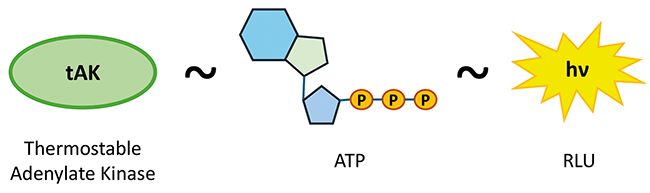
Enzyme indicators for H2O2 biodecontamination
Rubrik: Reinigung & Desinfektion
(Treffer aus cleanroom & processes, Nr. 03, Seite 156 (2024))
Riekert D | Schmid A | Demmler A | Bernhard L
Enzyme indicators for H2O2 biodecontamination / Influence of temperature and humidity · Riekert D1,2, Schmid A2, Demmler A1, Bernhard L1 · 1Optima pharma containment GmbH, Radolfzell-Stahringen und Hochschule Albstadt-Sigmaringen, Sigmaringen
Biodecontamination Isolator Enzyme Indicators Biological Indicators Aseptic Processing The aim of manufacturing sterile pharmaceuticals is to ensure the absence of viable microorganisms through reproducible process design. Both the European [ 1 ] and the United States Pharmacopoeia (USP) [ 2 ] as well as recommendations of the European Medicines Agency (EMA) [ 3 ] call for terminal sterilization in the final container as the method of choice, combined with a sterility assurance level (SAL) of 10 -6 or lower as a recognized acceptance criteria. The SAL value defines the probability of viable microorganisms remaining in the product batch after the ...
Sie sehen Artikel 781 bis 790 von insgesamt 11938
- Erste Seite
- 77
- 78
- 79
- 80
- 81
- Letzte Seite