Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-

PDCO – News
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 328 (2025))
PDCO – News / Throm | PDCO – News · Throm S
Kinderarzneimittel PIP Freistellung Compliance Check Pädiatrische Entwicklung Bei seiner Sitzung vom 28.–31. Jan. 2025 bei der Europäischen Arzneimittel-Agentur (EMA) in Amsterdam dankte der Ausschuss für Kinderarzneimittel (PDCO) dem bisherigen Mitglied für die Niederlande, Roderick Houwen, und dem bisherigen stellvertretenden Mitglied für Zypern, Maria Eleni Avraamidou. Er begrüßte Maaike Van Dartel als neues Mitglied für die Niederlande sowie Karijn Pijnenburg-Kleizen, Monica Trojan und Andria Eliadou als neue stellvertretende Mitglieder für die Niederlande, für Polen und für Zypern. Bei dieser Sitzung verabschiedete der PDCO: 10 Voten zu pädiatrischen Prüfkonzepten (PIP) für folgende in Entwicklung befindliche Medikamente: Telitacicept zur Behandlung der Myasthenia gravis bei ...
-

COMP – News
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 326 (2025))
COMP – News / Throm | COMP – News · Throm S
Humanarzneimittel Orphan Drugs Seltene Krankheiten Zuerkennungsverfahren Orphan-Zulassungen Der Ausschuss für Arzneimittel gegen seltene Krankheiten (Committee for Orphan Medicinal Products, COMP) dankte bei seiner Sitzung vom 21.–23. Jan. 2025 bei der Europäischen Arzneimittel-Agentur EMA in Amsterdam (EMA) dem bisherigen Mitglied Dinko Vitezic für Kroatien für dessen Beiträge und verabschiedete folgende Voten: 10 Empfehlungen für die Zuerkennung des Orphan-Status für die folgenden in Entwicklung befindlichen Medikamente: Adeno-assoziierter Virus vom Serotyp rh74, der das humane Sarkoglykan gamma(SGCG)-Gen enthält, zur Behandlung der Gliedergürteldystrophie; 44 900 Betroffene; Sarepta Therapeutics Epertinib zur Behandlung der amyotrophen Lateralsklerose; 58 370 Betroffene; 3R Pharma Consulting Hydroxocobalaminacetat zur Behandlung der Homocystinurie oder Methylmalonazidämie ...
-

CHMP und CMDh – News
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 320 (2025))
CHMP und CMDh – News / Throm | CHMP und CMDh – News · Throm S
Opinions Arzneimittelzulassung Pharmakovigilanz Anerkennungsverfahren Wissenschaftliche Beratung Bei der Sitzung des Ausschusses für Humanarzneimittel (CHMP) vom 24.–27. März 2025 bei der europäischen Arzneimittel-Agentur EMA in Amsterdam wurden folgende Ergebnisse erzielt: Der CHMP verabschiedete: 1 positives Votum für folgenden Hybrid-Antrag: Ryjunea® (Atropin): Augentropfen von Santen Oy zur Verlangsamung des Fortschreitens einer Myopie (Kurzsichtigkeit) bei Kindern von 3–14 Jahren mit einer jährlichen Progressionsrate von 0,5 Dioptrien und mehr und mit –0,5 bis –6,0 Dioptrien. Der Wirkstoff ist ein Anticholinergikum (Anatomischer-Therapeutischer-Chemischer[ATC]-Code: S01FA01), ein kompetitiver Antagonist, der die Muskarinrezeptoren vor einer Stimulation durch Acetylcholin schützt. Wie Atropin die Kurzsichtigkeit verlangsamt, ist noch nicht vollständig geklärt. Der Nutzen von Ryjunea ...
-

Das neue europäische Einheitspatentsystem
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 314 (2025))
Das neue europäische Einheitspatentsystem / Teil 1: Überblick und wichtige übergeordnete Themen der Anfangszeit · Traumann J, Grammel M · Grünecker Patent- und Rechtsanwälte
Patentrecht Einheitspatent Einheitliches Patentgericht Patentstrategie Schutzzertifikate Das europäische Einheitspatentsystem bietet zusätzlich zum Europäischen Patent und den nationalen Gerichten der Mitgliedsstaaten eine zusätzliche Option für den Patentschutz und die Durchsetzung von Patenten in der Europäischen Union (EU). Sein Ziel ist, das Patentrecht zu harmonisieren und einen einfachen, effizienten und kostengünstigen Weg zur Durchsetzung von Patenten in der EU zu bieten. Den rechtlichen Rahmen bilden 2 EU‑Verordnungen zum Einheitspatent [ 1 ] und ein internationales Übereinkommen, das Übereinkommen über ein Einheitliches Patentgericht [ 2 ]. Zum Start am 1. Juni 2023 nahmen 17 Mitgliedsstaaten der EU (sog. Vertragsmitgliedsstaaten) am europäischen Einheitspatentsystem teil, namentlich Deutschland, Frankreich, ...
-

Trusted Source für digitale Gebrauchsinfos
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 310 (2025))
Thurisch B | Ginnow B | Jahn S
Trusted Source für digitale Gebrauchsinfos / Risiken und Handlungsempfehlungen für sichere Informationen im Internet · Thurisch B, Ginnow B, Jahn S · Bundesverband der Pharmazeutischen Industrie
Gebrauchsinformationen Digitalisierung Trusted Source Arzneimittelgesetzgebung Arzneimittelsicherheit In der modernen, digital geprägten Welt ist der Zugang zu Gesundheitsinformationen über das Internet zu einem wesentlichen Bestandteil der Patientenversorgung geworden. Diese Entwicklung ermöglicht es Patienten, rasch und unkompliziert auf wertvolle Informationen über Arzneimittel zuzugreifen, was das Potenzial hat, die Patientensicherheit zu erhöhen und das Verständnis für die eigene Medikation zu vertiefen. Digitale Gebrauchsinformationen, die über verschiedene Online-Plattformen bereitgestellt werden, sind entscheidend, um den Patienten zu helfen, informierte Entscheidungen bzgl. ihrer Gesundheit zu treffen und ihre Therapie besser zu verstehen. Trotz dieser positiven Aspekte bergen die verfügbaren Informationsquellen auch beträchtliche Risiken. Viele Nutzer sind ...
-

Digitale Gebrauchsinformationen
Rubrik: europharm
(Treffer aus pharmind, Nr. 04, Seite 303 (2025))
Digitale Gebrauchsinformationen / Fortschritt für die Patientensicherheit · Bachmann C, Kamm P · Rote Liste® Service GmbH
Digitalisierung Digitale Gebrauchsinformation ePI EU-Pharmapaket Elektronische Packungsbeilage Electronic Product Information (ePI) ist der internationale Begriff für die digitalen Versionen von pharmazeutischen Produktinformationen, welche u. a. die Fach- und Gebrauchsinformationen enthalten. Es handelt sich hierbei um strukturierte Daten und grenzt sich somit vom PDF-Format ab. Fachinformationen dienen medizinischem Fachpersonal als Informationsquelle und Gebrauchsinformationen richten sich an Patienten. Für beide Nutzergruppen bieten ePI einen einfachen Zugang zu den aktuellen Versionen der Fach- und Gebrauchsinformationen, um somit die korrekte Anwendung von Medikamenten für mehr Patientensicherheit zu ermöglichen. Im konkreten Fall von Gebrauchsinformationen wird aus ePI Electronic Product Information Leaflet (ePIL). ePIL wird teilweise auch ...
-

G-BA und IQWiG – News
Rubrik: Gesundheitswirtschaft
(Treffer aus pharmind, Nr. 04, Seite 296 (2025))
G-BA und IQWiG – News / Frühe Nutzenbewertung und arzneimittelbezogene Beschlüsse im März 2025 · Wilken M, Lietz C · Bundesverband der Pharmazeutischen Industrie
G-BA IQWiG Arzneimittelbewertung Zusatznutzen Stellungnahmeverfahren Beschluss des G-BA vom 7. Jan. 2025 über eine Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage VIIa (Biologika und Biosimilars) – Aktualisierung Okt. 2024, veröffentlicht BAnz AT 28. Febr. 2025 B4 22. Nov. 2024 über eine Änderung der AM-RL in Anlage VII (Austauschbarkeit von Arzneimitteln) – Teil A (Perindoprilarginin+Indapamid), veröffentlicht BAnz AT 30. Jan. 2025 B2 Beschlüsse des G-BA vom 6. März 2025 zur Änderung der AM-RL in Anlage XII (Verfahren nach § 35a SGB V): Abemaciclib (neues Anwendungsgebiet: Mammakarzinom, HR+, HER2-, früh mit hohem Rezidivrisiko, Adjuvanz, Kombination mit endokriner Therapie) – Änderung der Befristung der Geltungsdauer Der G-BA hat mit Beschluss vom 20. Okt. 2022 über die ...
-
Wie Pflanzen Wärme messen
Rubrik: Exkurs
(Treffer aus pharmind, Nr. 04, Seite 292 (2025))
Wie Pflanzen Wärme messen / Stoll | Pflanzlicher Thermosensor · Stoll G
Pflanzenphysiologie Abscisinsäure Thermosensor Hitzestress Klimaerwärmung Eigentlich genügt schon ein einfacher Spaziergang, um es wahrzunehmen, aber man kann es sich auch amtlich bestätigen lassen, z. B. durch den Waldzustandsbericht, eben im März 2025 wieder aktualisiert: Um die Waldgesundheit steht es schlecht; etwa 44 % des eingeschlagenen Holzes sind durch Dürre, Pilze und Insekten geschädigt. Die letzten Jahre waren durch überdurchschnittlich hohe Temperaturen, zu wenig Niederschläge und damit in der Folge durch Dürreperioden gekennzeichnet [ 1 ]. Und was für den Baumbestand gilt, gilt auch für Getreide und Gemüse; der Verbraucher spürt es deutlich. Pflanzen leiden also, nicht wirklich erstaunlich, an Stress. Stressauslöser können ...
-

Fachwissen trifft Erfahrungsaustausch
Rubrik: Spektrum
(Treffer aus Tech4Pharma, Nr. 04, Seite 240 (2025))
Fachwissen trifft Erfahrungsaustausch / Das GMP-Forum verbindet Experten und Praxis
Austausch unter Gleichgesinnten, praxisnahe Fachvorträge und neue Impulse für die tägliche Arbeit: Das GMP-Forum von Testo Industrial Services bot den Teilnehmern echten Mehrwert. In 14 Fachvorträgen sprachen die Experten über aktuelle Trends und „Evergreen-Themen“ wie z. B. über Data Integrity oder Energieeffizienz im Reinraum sowie über GMP-gerechte Kalibrierung, Prüfmittelverwaltung oder wirtschaftliche Validierungsansätze. Die 3 am häufigsten gebuchten Vorträge des Tages zeigen, was die GMP-Branche umtreibt: „Reinraumqualifizierung – Kann auf Papier verzichtet werden?“ Fazit des Referenten: Das kann gelingen, wenn die Basis für dem Umstieg strukturiert vorbereitet wird. „Vereinfachte Dokumentation für flexible Softwarevalidierung“: Hier zeigte die Referentin praxisnahe Wege für solche Projekte ... -
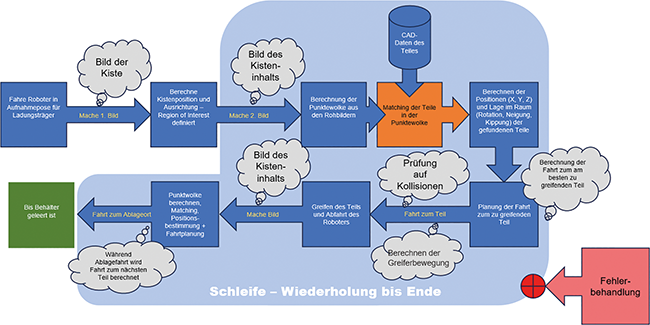
Kamerageführte Robotik
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 04, Seite 234 (2025))
Kamerageführte Robotik / Teil 2* Teil 1 dieses Beitrags s. Tech4Pharma 2025;15(3):132–139.: Workflows und Robotertechnik für maximale Produktivität · Purwin R · Optonic
Kollisionsvermeidung Roboterbahnplanung Digitaler Zwilling GAMP5 GMP-Konformität Der Roboter als zentrales Werkzeug zum Picken, Greifen, Manipulieren von Teilen ist gesetzt. Dass das nur mit einer 3-D-Kamera als „Augen für den Roboter“ funktioniert, ist einleuchtend. Aber zur funktionierenden Lösung gehören weitere Bausteine. Roboter verfügen üblicherweise über eine individuelle Steuerung. Jeder Roboterhersteller hat seine eigene Version, mit je eigenen Programmieroptionen und eigener Bedienung. Deshalb entscheidet sich der Anwender i. d. R. für eine bestimmte Robotermarke, um nicht selbst das nötige Expertenwissen für unterschiedliche Robotermodelle aufbauen zu müssen. Roboter benötigen eine Programmierung, um von einem Punkt zum anderen zu fahren. Das kann über das sog. „Teachen“ ...
Sie sehen Artikel 271 bis 280 von insgesamt 11970
- Erste Seite
- 26
- 27
- 28
- 29
- 30
- Letzte Seite