Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11583 Beiträge für Sie gefunden
-
Aktivitäten des PRAC
Rubrik: europharm
(Treffer aus pharmind, Nr. 02, Seite 262 (2020))
Aktivitäten des PRAC / Aktuelle Empfehlungen des Ausschusses für Risikobewertung im Bereich der Pharmakovigilanz der Europäischen Arzneimittel-Agentur (EMA) · Thurisch B, Sickmüller B · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee, PRAC) ist in erster Linie für die Beurteilung aller Aspekte des Risikomanagements von Humanarzneimitteln zuständig. Dies umfasst die Ermittlung, Bewertung, Minimierung und Kommunikation der Risiken von Nebenwirkungen, unter gebührender Berücksichtigung des therapeutischen Nutzens des Humanarzneimittels, der Gestaltung und Bewertung der Unbedenklichkeitsstudien nach der Genehmigung sowie Pharmakovigilanz-Audits. Der PRAC gibt somit – abhängig vom jeweiligen Verfahren – Empfehlungen an den Ausschuss für Humanarzneimittel (Committee for Medicinal Products for Human Use, CHMP), die Koordinierungsgruppe (Co-ordination Group for Mutual Recognition an Decentralised Procedures, CMDh), die Europäische Arzneimittel-Agentur (EMA) oder die Europäische ...
-
Brexit
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 02, Seite 267 (2020))
Brexit / Herausforderungen beim grenzüberschreitenden Verkehr mit Arzneimitteln aus Sicht der Bundesrepublik Deutschland · Brixius K, Knieps S · Köln und Leverkusen
Die Entscheidung des britischen Referendums vom 23.06.2016, nach dem das Vereinigte Königreich die Europäische Union in einem Verfahren nach Art. 50 EUV verlassen soll, wirft zahlreiche Fragen auf, die die traditionell stark regulierte pharmazeutische Industrie in Deutschland (und Europa) seither intensiv beschäftigen; die ständigen Diskussionen um die konkrete Ausgestaltung jenes „Brexits“ – hart oder mit Abkommen – befeuern nachhaltig die anhaltende Unsicherheit.
-
Essentials aus dem Pharma- und Sozialrecht
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 02, Seite 277 (2020))
Essentials aus dem Pharma- und Sozialrecht / Der Vertrieb apothekenpflichtiger Arzneimittel über Amazon Marketplace – Urteile des OLG Naumburg vom 07.11.2019 – Az. 9 U 39/10 und 9 U 6/19 · Ehlers A, Schwiegk N · Ehlers, Ehlers & Partner Rechtsanwaltsgesellschaft mbB, München
Das Oberlandesgericht Naumburg (OLG Naumburg) hat sich im Nov. 2019 mit der Thematik des Vertriebs apothekenpflichtiger Arzneimittel über Amazon Marketplace befasst und entschieden, dass ein Verstoß gegen § 3a des Gesetzes gegen den unlauteren Wettbewerb (UWG) vorliege, wenn apothekenpflichtige Arzneimittel auf dem Amazon Marketplace vertrieben werden, solange nicht sichergestellt sei, dass der Kunde vorab ausdrücklich seine Einwilligung in die Erhebung, Verarbeitung und Nutzung seiner Gesundheitsdaten gegenüber dem Apotheker erteilt habe.
-
Qualifizierung von Thermoversandgebinden
Rubrik: GMP-Aspekte in der Praxis
(Treffer aus pharmind, Nr. 02, Seite 279 (2020))
Qualifizierung von Thermoversandgebinden / Temperaturprofile und Prüfszenarien · Spiggelkötter N · Knowledge & Support, Bad Harzburg
Die Qualifizierung von Thermoversandgebinden umfasst die Designqualifizierung, bei der grundlegende Anforderungen definiert werden, und die anschließende Funktions- und Leistungsqualifizierung, bei der die Leistungsdaten des Gebindes ermittelt werden. Bei der Auswahl eines geeigneten Thermoversandgebindes sind zahlreiche Bewertungs- und Leistungskriterien zu berücksichtigen. Für die Funktionsqualifizierung, die am leeren Gebinde durchgeführt wird, muss ein geeignetes Temperaturprofil ausgewählt werden. Hierbei unterscheidet man grundsätzlich zwischen Profilen mit konstanter Außentemperatur und solchen mit wechselnden Temperaturen. Bei der Leistungsqualifizierung wird das Temperaturhaltevermögen der beladenen Box unter Realbedingungen geprüft.
-
Anticalin-Proteine als neue Wirkstoffklasse
Rubrik: Übersichten
(Treffer aus pharmind, Nr. 02, Seite 283 (2020))
Ilyukhina
Anticalin-Proteine als neue Wirkstoffklasse / Für therapeutische Anwendungen · Ilyukhina* Diese Autoren haben in gleichem Maße zu dieser Arbeit beigetragen. * Diese Autoren haben in gleichem Maße zu dieser Arbeit beigetragen.
Anticalin® Biopharmazeutikum Lipocalin Protein-Design Proteintherapeutikum Therapeutische Antikörper bilden derzeit eine der wichtigsten biopharmazeutischen Wirkstoffklassen, die sich neben der biomedizinischen Grundlagenforschung für ein breites Anwendungsspektrum in der Behandlung und Diagnostik von Erkrankungen bewährt haben. Trotz des großen ökonomischen Erfolgs dieser Proteine gerade im biopharmazeutischen Sektor erfordert deren Produktion kostspielige Säugetier-Expressionssysteme aufgrund des komplexen Aufbaus aus 12 Immunglobulindomänen (bei IgG1) mit zahlreichen Disulfidbrücken und obligatorischer Glykosylierung. Die beachtliche Molekülgröße von ~150 kDa erschwert einerseits die Gewebepenetration und hat andererseits – in Verbindung mit dem FcRn-vermittelten endosomalen Recyclingprozess – eine lange Plasmahalbwertszeit von mehreren Tagen zur Folge. Ferner können die durch den Fc-Teil vermittelten immunologischen ...
-
„If automation keeps up, man will atrophy all his limbs – but the push-button finger.“
Rubrik: Editorial
(Treffer aus TechnoPharm, Nr. 03, Seite 125 (2020))
„If automation keeps up, man will atrophy all his limbs – but the push-button finger.“ / Editorial
Sehr geehrte Leserinnen und Leser, mit diesem Spruch zeichnet der US-amerikanische Architekt Frank Lloyd Wright ein eher düsteres Bild von Automation. Jedoch starb er bereits 1959 – hatte also gerade einmal die Chance, von Industrie 3.0 (Einsatz von Computern) die Kindheit mitzubekommen. Bei dem, was heute diesbzgl. State of the Art ist, käme er aus dem Staunen nicht heraus; und doch ist der Mensch aus dem Produktionsprozess noch nicht wegzudenken. Die Messe interpack bezeichnet die Automation als Pharmatrend: „Mithilfe von Künstlicher Intelligenz können bessere Medikamente und Therapien entwickelt werden. Robotic Process Automation, bekannt als Bots, kann Entwicklungskosten deutlich senken, Prozesse ... -
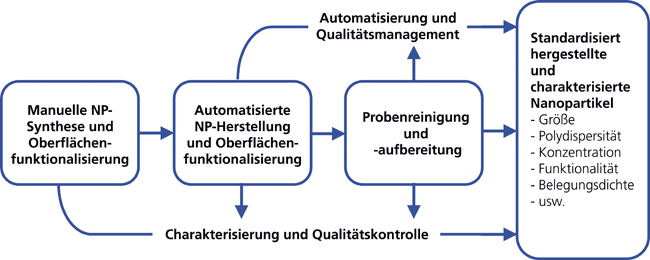
Automatisierte Produktion von Nanopartikeln mithilfe flexibler interaktiver Robotertechnik
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 03, Seite 130 (2020))
Dembski S | Probst J | Hansmann J | Schwarz T | Hertwig J | Fechner P | Müller A | Dressler D | Pullig O | Reutter A
Automatisierte Produktion von Nanopartikeln mithilfe flexibler interaktiver Robotertechnik / Dembski et al. • Nanopartikelproduktion mit Robotern · Dembski S, Probst J, Hansmann J, Schwarz T, Hertwig J, Fechner P, Müller A, Dressler D, Pullig O, Reutter A · 1Fraunhofer-Institut für Silicatforschung ISC, Würzburg und Lehrstuhl Tissue Engineering und Regenerative Medizin TERM, Universitätsklinik Würzburg, Würzburg und Hochschule für angewandte Wissenschaften Würzburg-Schweinfurt, Schweinfurt, und Goldfuß engineering GmbH, Balingen und Biametrics GmbH, Tübingen, und BioTeSys GmbH, Esslingen, und BioRegio STERN Management GmbH, Stuttgart und
Laborautomatisierung Nanopartikelsynthese GMP Roboter Diagnostika Robotik und Automatisierung gehören zweifelsohne zu den Megatrends des 21. Jahrhunderts. Auch in den Life Sciences hat diese Entwicklung zunehmend Einzug gehalten. Wesentliche Treiber hierfür sind der steigende Kostendruck, u. a. durch erhöhten Personalaufwand und Laborausstattung (Stichwort: Freisetzung von Personalkapazitäten), die Beschleunigung von Arbeitsabläufen und die dadurch einhergehende schnellere Bearbeitung von Analysen, ein besseres Qualitätsmanagement, die hohen regulatorischen Auflagen bei der Herstellung (Good-Manufacturing-Practice(GMP)-gerechte Produktion) sowie eine breitere Verfügbarkeit von Fertigungstechnologien für den Endanwender. Es existieren aber Bereiche, in denen Automatisierungstechnik momentan nur einen geringen Stellenwert einnimmt. Ein Beispiel hierfür ist die Herstellung von Nanopartikeln (NP). Dank großer ...
-
Kontinuierliche Tablettenherstellung
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 03, Seite 140 (2020))
Hörmann T | Rehrl J | Lara-Garcia R | Holman J
Kontinuierliche Tablettenherstellung / Die Strategie für Qualitätskontrolle als Funktion von Pulvereigenschaften · Hörmann T, Rehrl J, Lara-Garcia R, Holman J · RCPE GmbH, Graz (Österreich) und GEA Group, Wommelgem (Belgien)
Kontinuierliche Tablettenherstellung Qualitätskontrolle Rückverfolgbarkeit Pulvereigenschaften Die treibende Kraft hinter der Etablierung kontinuierlicher Herstellungsverfahren in der pharmazeutischen Industrie ergibt sich aus 2 Faktoren: Einerseits sind sie Reaktion auf eine Initiative der US-amerikanischen Regulierungsbehörde FDA, welche aus einer gestiegenen Zahl an Medikamentenengpässen und -rückrufen hervorging. Andererseits erfordert die steigende Komplexität vieler neu entwickelter Wirkstoffe auch komplexe, aber dennoch robuste Prozessrouten, um diese neuen Produkte erfolgreich auf den Markt zu bringen. Der Fokus der FDA-Initiative war es, pharmazeutischen Herstellern mehr Freiheiten in der Verbesserung von veralteten und ineffizienten Prozessen zu geben und gleichzeitig mehr Prozessverständnis einzufordern. Hinsichtlich der Komplexität von pharmazeutischen Herstellungsrouten für feste ...
-
Robotics of the future in the pharmaceutical industry
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 03, Seite 150 (2020))
Robotics of the future in the pharmaceutical industry / Coulon • Robotics of the future · Coulon C · INVITE GmbH, Leverkusen
Robotics Pharmaceutical industry Automation Production Laboratory Requirements regarding quality, ergonomics and efficiency reveal the necessity to a much higher degree of automation for the production of pharmaceuticals. In addition, for safety reasons the industry is asked to technically separate humans and high potent substances wherever possible [ 1 , 2 ]. However, looking at production, many activities are currently still carried out by humans, even though there are strong reasons to avoid it. The main message of this article is the hypothesis that modern robotics will provide the pharmaceutical industry with cost-effective and easy-to-use flexible applications as soon as the ...
-
Cyber Security by Design in der Anlagenplanung und -realisierung
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 03, Seite 158 (2020))
Mettler H | Krausz S | Jebari A
Cyber Security by Design in der Anlagenplanung und -realisierung / Teil 2*Teil 1 dieses Beitrags ist erschienen in TechnoPharm 10, Nr. 2, 108-111 (2020). · Mettler H, Krausz S, Jebari A · Exyte Central Europe, Stuttgart
Die ISO-Normenfamilie 2700X legt die Anforderungen für die Einrichtung, Umsetzung, Aufrechterhaltung und fortlaufende Verbesserung eines Informationssicherheitsmanagementsystems (ISMS) im Kontext der Organisation fest. Außerdem beinhaltet sie Anforderungen für die Beurteilung und Behandlung von Informationssicherheitsrisiken entsprechend der individuellen Bedürfnisse der Organisation. Die Anforderungen sind allgemein gehalten und sollen auf alle Organisationen anwendbar sein, ungeachtet ihrer Art und Größe [ 20 ]. In der Norm ISO 27002 werden konkrete Vorgaben zur Umsetzung genannt. Automatisierte und computerisierte Systeme wurden in den letzten Jahren ein maßgeblicher Bestandteil sowohl in der Bearbeitung als auch in der Speicherung und Archivierung von GMP-relevanten Informationen entlang der Wertschöpfungskette im Unternehmen. Folglich ...
Sie sehen Artikel 9171 bis 9180 von insgesamt 11583
- Erste Seite
- 916
- 917
- 918
- 919
- 920
- Letzte Seite