Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-
High-pressure cleaning in pharmaceutical production – a hitherto unjustly neglected technology!
Rubrik: Maschinen- und Anlagenbau
(Treffer aus Tech4Pharma, Nr. 02, Seite 92 (2024))
High-pressure cleaning in pharmaceutical production – a hitherto unjustly neglected technology! / Advantages and huge potential of sustainability and savings · Scheibel R · Tecniplast Deutschland GmbH, Hohenpeißenberg
high-pressure cleaning cGMP cleaning cleaning automation IBC cleaning system CIP/COP Automation of the cleaning of parts and tools coming from the production of pharmaceutical manufacturing became quite a standard within Good Manufacturing Practice (GMP) productions. Through fully validated cleaning processes and applications, safety could be achieved regarding cleaning success. Current Good Manufacturing Practice (cGMP) parts- and container-washers are available with different sizes of enclosed washing chambers that ensure cleaning success in pharmaceutical production under fully qualified status ( fig. 1 ). Nevertheless, there are applications and parts that cannot be applied to such a washing system because of their size or ...
-
Schutz von kritischen Komponenten vor Oberflächenkontaminationen
Rubrik: Ausstattung
(Treffer aus cleanroom & processes, Nr. 02, Seite 96 (2024))
Kopp A | Moschner C | Müller A
Schutz von kritischen Komponenten vor Oberflächenkontaminationen / Teil 2*Teil 1 dieses Beitrags s. cleanroom & processes 2024;3(1): 4–9. · Kopp A, Moschner C, Müller A · Dastex Reinraumzubehör GmbH & Co. KG, Muggensturm und OHB System AG, Bremen
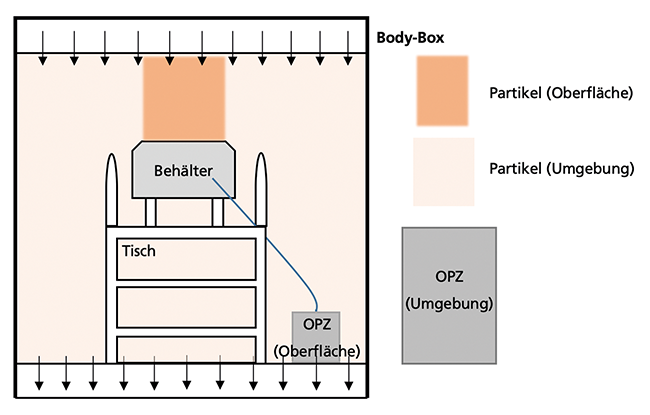
Der erste Teil der Versuche wurde in der Dastex Body-Box durchgeführt. Dabei handelt es sich um einen definierten, laminar durchströmten Reinraum mit Partikel-Monitoring, in welchem Vergleichsstudien durchgeführt werden können. Abbildung 7 zeigt schematisch den Aufbau. Als kritisches Objekt wurde ein Edelstahlbehälter eingesetzt, welcher gut ausgemessen und in den Ausgangszustand zurückversetzt werden kann. Der Behälter wurde mit einem Loch versehen, sodass eine isokinetische Sonde darin platziert werden konnte. Durch die Isokinetik wird sichergestellt, dass die luftgetragenen Partikel, welche sich oberhalb der kritischen Oberfläche befinden, dem Partikelzähler zur Detektion zugeleitet werden [ 2 ]. Durch diesen optischen Partikelzähler (OPZ) erfolgte die Detektion der ...
-
Einbindung von Gefriertrocknern in den aseptischen Fertigungsprozess
Rubrik: Maschinen- und Anlagenbau
(Treffer aus Tech4Pharma, Nr. 02, Seite 100 (2024))
Einbindung von Gefriertrocknern in den aseptischen Fertigungsprozess / Bieler und Fischer • Gefriertrockner · Bieler S, Fischer F · PPT Pharma Process Technology GmbH, Frankfurt am Main
Gefriertrocknung Prozessführung Reinraum Aseptische Abfülllinie Barrieresysteme Die Gefriertrocknung wird in der pharmazeutischen Industrie seit vielen Jahren eingesetzt, um die Haltbarkeit sensitiver Produkte zu verlängern, indem den thermolabilen Wirkstoffen das Lösungsmittel (meist Wasser) entzogen wird. Typische im Pharmabereich gefriergetrocknete Produkte sind solche, die sich bei erhöhten Temperaturen zersetzen oder denaturieren, wie etwa Impfstoffe, Antibiotika, Seren oder proteinhaltige und biotechnologische Produkte. Bei der Gefriertrocknung, auch Lyophilisation genannt, wird die Produktlösung bei Atmosphärendruck eingefroren und anschließend ein Vakuum angelegt. Dabei geht das Lösungsmittel direkt von dem festen in den gasförmigen Zustand über. Diesen Vorgang bezeichnet man als Sublimation. Die Lyophilisation ist ein Teil ...
-
Präsenzschulungen sind besonders wertvoll – v. a. für Reinraumpersonal!
Rubrik: Reinraumkontext
(Treffer aus cleanroom & processes, Nr. 02, Seite 102 (2024))
Präsenzschulungen sind besonders wertvoll – v. a. für Reinraumpersonal! / Beckmann • Präsenzschulungen · Beckmann G · Institut Romeis Bad Kissingen, Oberthulba
Erwachsenengerechtes Lernen Präsenzschulung Onlineschulung Erfolgskontrollen Erwachsenenpädagogik In der pharmazeutischen Industrie inkl. der dort betriebenen Reinräume besteht eine regulatorische Verpflichtung zu regelmäßigen Schulungen und folgenden Erfolgskontrollen [ 1 ]. Dies wird den zunehmend arbeitsteiligen und komplexeren Aufgaben der zu Schulenden in verschiedenen Produktionszweigen gerecht – man denke nur an die Sterilfertigung und verschiedene „Entwicklungsstufen“ der Reinraumtechnik. Dass der arbeitende Mensch lebenslanger Fort- und Weiterbildung bedarf, ist in Zeiten eines beschleunigten Struktur- und Methodenwandels sowie epochalen Änderungen in der Arbeitswelt (Stichwort: Digitalisierung) und dem fortwährenden Zwang zur Ausbildung von Mitarbeitern On-the-Job aufgrund der Marktlage (Fachkräftemangel, Kostendruck usw.) unausweichlich und aus Qualitäts- und ...
-
Eingebettete Prozessanalysetechnik in der kontinuierlichen Tablettenproduktion
Rubrik: Analytik
(Treffer aus Tech4Pharma, Nr. 02, Seite 106 (2024))
Eingebettete Prozessanalysetechnik in der kontinuierlichen Tablettenproduktion / Inline-Prozessüberwachung durch vollständig integrierte spektroskopische Instrumente · Geiger J, Novikova A · Fette Compacting, Schwarzenbek
Eingebettete Prozessanalysetechnik (ePAT) Kontinuierliche Produktion Tablettenproduktion Direktverpressung Nahinfrarotspektroskopie (NIRS) Marktforscher prognostizieren bis 2027 bei der kontinuierlichen Produktion (Continuous Manufacturing, CM) für die Pharmaproduktion ein überdurchschnittliches Wachstum von jährlich rund 10 % [ 1 ]. Auch die Lebens- und Arzneimittelbehörde der USA (Food and Drug Administration, FDA) sieht in der kontinuierlichen Herstellung ein entscheidendes Werkzeug zur Modernisierung der pharmazeutischen Industrie [ 2 ]. Ein wesentlicher Grund dafür sind demnach Verbesserungen bei der Produktqualität und der Patientensicherheit in Folge einer häufig erhöhten Prozesskontrolle. Darüber hinaus weisen kontinuierliche Verfahren gegenüber Batch-to-Batch-Produktionen grundsätzliche Vorteile auf: Neben der erhöhten Prozesssicherheit und Effizienz durch integrierte Prozesse ...
-

Alles im Fluss?
(Treffer aus cleanroom & processes, Nr. 02, Seite 107 (2024))
Alles im Fluss? / Ultraschall-assistierte Dekontamination für Isolatoren · Ludwig T
Beim Einsatz vernebelten Wasserstoffperoxids ist die gleichmäßige Verteilung des Desinfektionsmittels kritisch. Forschende der Universität Tokyo haben nun simuliert, wie Ultraschall dabei helfen kann. Isolatoren und Barrieresysteme müssen regelmäßig dekontaminiert werden. Im Pharma-Bereich kommt dafür hauptsächlich verdampftes (vapor phase hydrogen peroxide, VPHP) oder vernebeltes (aerosol hydrogen peroxide, AHP) Wasserstoffperoxid (H 2 O 2 ) zum Einsatz. Die Verwendung von AHP hat zwar einige Vorteile gegenüber VPHP, doch die Reichweite des reinigenden Nebels ist begrenzt. Studien zeigen, dass der Dekontaminationseffekt mit zunehmender Entfernung von der Injektionsstelle des AHP abnimmt. Die homogene Verteilung des Wasserstoffperoxidnebels ist also kritisch. Eine vielversprechende Methode hierfür ...
-

Ötzi, das Kulturerbe und der Klimawandel
Rubrik: Aus Wissenschaft und Forschung
(Treffer aus pharmind, Nr. 02, Seite 107 (2024))
Ötzi, das Kulturerbe und der Klimawandel / pharmind • Aus Wissenschaft und Forschung · Stoll G · Filderstadt
Archäologie Gletscherschmelze Denkmalschutz Windkraft Fotovoltaik Am 20.09.1991 befand sich das Nürnberger Ehepaar Erika und Helmut Simon auf der Rückkehr von einer Bergwanderung in den Ötztaler Alpen, als sie in 3 210 m Höhe am Tisenjoch auf einen mumifizierten Leichnam stießen. Weder die Entdecker noch die herbeigerufenen Rettungskräfte erkannten sofort, dass es sich nicht um einen erst kürzlich verunglückten Bergsteiger handelte. Erst nachdem der Leichnam in der Gerichtsmedizin der Universität Innsbruck untersucht wurde, erfasste der Archäologe Konrad Spindler die wahre Bedeutung des Fundes und initiierte die systematische Erforschung des rasch als Ötzi weltweit bekannten Toten. Heute weiß man, dass er vor etwa 5 300 Jahren ...
-

50 Jahre Pfennig Reinigungstechnik
Rubrik: Partner der Industrie
(Treffer aus cleanroom & processes, Nr. 02, Seite 109 (2024))
50 Jahre Pfennig Reinigungstechnik / Partner der Industrie
Die Türen in die Reinräume nahezu aller Pharmakonzerne öffnete der Pfennig Reinigungstechnik ein gar nicht so zufälliger Zufall und die Bereitschaft, zuzuhören. Als Herbert Pfennig sein Unternehmen 1974 im Oberallgäuer Durach gründete, wuchs die Firma zunächst stark über den Vertrieb, die Fertigung und schließlich Entwicklung von Materialien für Gebäudereiniger, die in Kliniken tätig waren. Pfennig hatte für einen absatzstarken mechanischen Reinigungswagen die Ringo-Flachpresse und das EasyMop-Verfahren entwickelt. Dadurch wurde plötzlich berührungsfreies Arbeiten möglich: Der Mopp musste zum Auspressen nicht mehr per Hand vom Gestänge abgenommen werden. Gleichzeitig wurde verhindert, dass kontaminierte Textilien direkt wiederverwendet werden. Vorteile, die in Reinräumen noch ... -

35 Jahre ZETA
Rubrik: Partner der Industrie
(Treffer aus cleanroom & processes, Nr. 02, Seite 110 (2024))
35 Jahre ZETA / Partner der Industrie
ZETA wurde 1989 in Graz (Österreich) von Gerhard Zehetner und Manfred Tabor als Planungsbüro gegründet. Der Name des Unternehmens setzt sich aus den Anfangsbuchstaben der beiden Gründer zusammen. ZETA hat sich die Beschleunigung der Prozesse zur Markteinführung lebenswichtiger Medikamente zur Mission erklärt und ist in den letzten 12 Jahren zu einem Weltmarktführer im Bereich Prozesstechnologie für biopharmazeutische Produktionsanlagen aufgestiegen. Diese rasante Entwicklung nahm 2011 ihren Ausgang: Als Karl-Franz Maier, Alfred Marchler, Doris Maier und Andreas Marchler das Unternehmen gekauft hatten, war ZETA eine Firma mit 120 Mitarbeitenden und einem eingeschränkten Portfolio. Das hat sich gründlich geändert: Die ZETA Gruppe ist heute ein ... -

Aktuelles aus G-BA und IQWiG
Rubrik: Gesundheitswesen
(Treffer aus pharmind, Nr. 02, Seite 111 (2024))
Aktuelles aus G-BA und IQWiG / Aktuelle Verfahren der Frühen Nutzenbewertung / Arzneimittelbezogene Beschlüsse des G-BA im Dez. 2023/Jan. 2024 · Wilken M, Lietz C · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Es ist zu beachten, dass die Beschlüsse zur Frühen Nutzenbewertung bereits vor Veröffentlichung im Bundesanzeiger in Kraft treten. Deshalb können Veröffentlichungsdatum und das Datum des Inkrafttretens auseinanderfallen. Beschlüsse des Gemeinsamen Bundesausschusses (G-BA) vom 21. Dez. 2023 zur Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage XII (Verfahren nach § 35a SGB V): Axicabtagen-Ciloleucel (neues Anwendungsgebiet: diffus großzelliges B-Zell-Lymphom, hochmalignes B-Zell-Lymphom, nach 1 Vortherapie, Rezidiv innerhalb von 12 Monaten oder refraktär) Es handelt sich um die Bewertung eines neuen Anwendungsgebietes für ein Arzneimittel zur Behandlung seltener Leiden (Orphan Drug). Es sollten 2 Fragestellungen beantwortet werden: A) Die Behandlung von Patienten, für die eine Hochdosistherapie infrage kommt (zweckmäßige Vergleichstherapie ...
Sie sehen Artikel 11081 bis 11090 von insgesamt 11970
- Erste Seite
- 1107
- 1108
- 1109
- 1110
- 1111
- Letzte Seite