Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-
446 Fußballfelder Reinraum – und es werden mehr!
Rubrik: Editorial
(Treffer aus cleanroom & processes, Nr. 02, Seite 59 (2024))
446 Fußballfelder Reinraum – und es werden mehr! / Editorial
Liebe Leserinnen und Leser, 3,3 Mio. m 2 – das ist die Bodenfläche, die die Reinräume der DACH-Region laut einer aktuellen Marktanalyse [ 1 ] für sich beanspruchen. Damit Sie ein Gefühl für die Dimensionen bekommen: 3,3 Mio. m 2 entsprechen knapp der Fläche des New Yorker Central Parks oder etwa 446 Fußballfeldern, um ein europäisches Maß zu verwenden. Am meisten verbreitet bleibt der Einsatz von Reinräumen – wenig überraschend – in den Branchen Pharma, Chemie und Mikroelektronik. Gestiegene Qualitätsanforderungen veranlassen jedoch auch Unternehmen aus Maschinenbau, Optik, Automotive, Food, Biotech und Batterieproduktion immer häufiger dazu, Teile ihrer Fertigung in Reinräume zu verlagern. Gerade der deutsche ... -
Die großen Veränderungs- und Entwicklungspotenziale in der Reinraumtechnik
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 02, Seite 62 (2024))
Die großen Veränderungs- und Entwicklungspotenziale in der Reinraumtechnik / Ortner • Reinraumtechnik · Ortner J · Ortner Reinraumtechnik GmbH, Villach
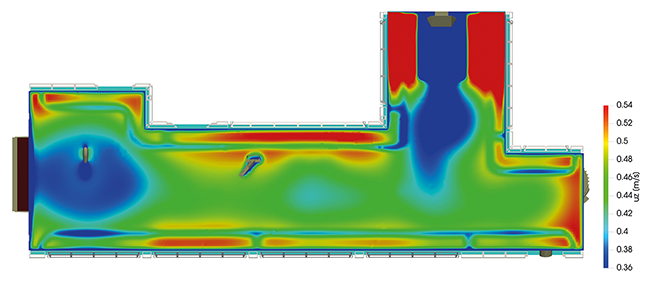
Reinraumtechnik der Zukunft und die großen Veränderungsenergien Reinheit als gesamtheitliche Betrachtung fördert innovative Entwicklung Moderne Kooperationsmodelle verbessern die Ergebnisse und erhöhen die Qualität Die Isolator-Philosophie hat das Potenzial, die Reinraumtechnik zu revolutionieren. Reinraumtechnik Mikrobiologische Reinheit Strömungstechnik Automatisierung Branchenunterschiede Der Begriff „Reinraumtechnik“ begründet sich im Begriff „Reinheit“. Die Reinraumtechnik entwickelte sich in den letzten ca. 100 Jahren von ursprünglich simplen Einrichtungen und Techniken zu einer hochkomplexen Technologie. Eine wesentliche Grundsäule der Reinraumtechnik bilden Normen und Regelwerke, welche sich quer durch alle Branchen ziehen. Normen und Regelwerke sind wichtig – sie sind aber immer ein Kompromiss zwischen Daten, Fakten und Meinungen verschiedener Experten ...
-

Banzaiiiiiiiiiii!!!
Rubrik: Editorial
(Treffer aus Tech4Pharma, Nr. 02, Seite 65 (2024))
Banzaiiiiiiiiiii!!! / Editorial
Sehr geehrte Leserinnen und Leser, „Deutschland zählt zu den modernsten pharmazeutischen Produktionsstandorten weltweit. Jedes Jahr investieren die Unternehmen der Branche mehr als 2 Mrd. Euro in neue Maschinen und Anlagen. Den Herausforderungen sowohl der Energiewende wie auch der Digitalisierung müssen auch sie mit einem deutlich erhöhten Investitionsvolumen begegnen. Nur so kann sich Deutschland weiter als innovativer Produktionsstandort behaupten.“ (Pharma 2030, Verband Forschender Arzneimittelhersteller e. V.) Diesen Worten dürfte wohl niemand widersprechen – allenfalls „Sparfüchse“ und Verfechter einer Laissez-faire-Wirtschaft. Wobei sich inzwischen klar gezeigt haben sollte, dass ein Ansatz a lá „Wird schon!“ ökonomischem Harakiri gleichkommt… Folglich ist es unerlässlich, die Pharma-Prozesstechnik immer ... -
Fill-and-Finish-Prozesse und der Annex 1
Rubrik: Reinraum
(Treffer aus Tech4Pharma, Nr. 02, Seite 70 (2024))
Fill-and-Finish-Prozesse und der Annex 1 / Auswirkungen und Innovationen · Wagner R · Optima pharma GmbH, Schwäbisch Hall
Annex 1 Fill-and-Finish Isolator Contamination Control Strategy (CCS) First Air Ein zentraler Aspekt des Annex 1 des EU-Leitfadens zur Good Manufacturing Practice (GMP) ist die Contamination Control Strategy (CCS), die gewissermaßen das Fundament der Prozesse eines pharmazeutischen Verarbeiters bilden wird (§§ 2.3–2.6). In die CCS hat der pharmazeutische Verarbeiter nicht nur sterile Herstell-, Füll- und Verschließprozesse, das Monitoring und Prozesskontrollen einzubeziehen, sondern auch organisatorische und weitere Aspekte, die auf das sterile Arzneimittel als Endprodukt Einfluss nehmen können (vgl. dazu die Definition zu CCS im Glossar des Annex 1). Gefordert wird im Annex 1 ein Quality Risk Management. Dieses besagt, dass Prozesse gemäß einer risikobasierten ...
-
Aufbau, Einsatz und Dekontamination von Isolatoren
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 02, Seite 72 (2024))
Aufbau, Einsatz und Dekontamination von Isolatoren / Teil 1 · Denk R · SKAN AG, Allschwil
Barriere-Systeme Annex 1 Handschuhe First-Air Dekontamination Isolatoren kommen in der aseptischen Herstellung in unterschiedlichen Bereichen zum Einsatz. Am häufigsten findet man sie bei der Handhabung von sterilen Produkten. Diese können in flüssiger oder auch fester Form (Feststoff) vorliegen. Auch menschliche oder tierische Zellen werden in neuen Therapien immer häufiger verwendet, z. B. für Zell- und Gen-Therapeutika, die ebenfalls unter aseptischen Bedingungen verarbeitet werden. Nachfolgend werden einige Beispiele für den Einsatz von Isolatoren vorgestellt. Auch wenn menschliche oder tierische Zellen zur Verwendung für neue Therapien aufgrund ihrer Entnahme (meistens in Krankenhäusern) nicht als steril angesehen werden können, besteht auch hier die Anforderung, ...
-
Innovative Dichtheitsprüfverfahren zur Erfüllung der Anforderungen des Annex 1 des EU-GMP-Leitfadens
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 02, Seite 78 (2024))
Innovative Dichtheitsprüfverfahren zur Erfüllung der Anforderungen des Annex 1 des EU-GMP-Leitfadens / Mettraux • Dichtheitsprüfverfahren · Mettraux M · Wilco AG, Wohlen
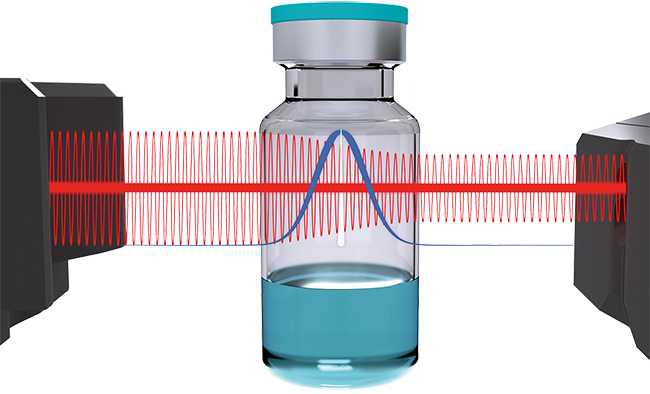
EU GMP Annex 1 Nichtdestruktive Dichtheitsprüfverfahren Aseptisches Abfüllen Media-Fill CO 2 -Bombing Die Headspace-Analyse (HSA) ist eine etablierte Methode zur berührungslosen Dichtheitsprüfung verschiedenster Behälter in der Pharmaindustrie [ 1 ] [ 2 ]. Wie der Name schon andeutet, wird der Kopfraum über dem Produkt analysiert. Eine weit verbreitete Technology zur Analyse des Headspace ist die sog. Tunable Diode Laser Absorption Spectroscopy (TDLAS). Dabei wird mittels einer durchstimmbaren Laserdiode die Absorption gemessen ( Abb. 1 ). Die Wellenlänge des Lasers wird so ausgewählt, dass sie mit den Absorptionslinien des Zielgases übereinstimmt. Die damit gewonnenen Erkenntnisse lassen Aussagen über die Konzentration oder den Partialdruck ...
-
Druckluft im Reinraum
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 02, Seite 80 (2024))
Druckluft im Reinraum / Werner • Druckluft · Werner D · Hanns G. Werner GmbH + Co. KG, Tornesch
Druckluft Reinraum Annex 1 Partikeleintrag Luftkeimzahl Druckluftanwendungen im Reinraum stellen für die Qualifizierung eine besondere Herausforderung dar [ 1 ]. Druckluft gilt als ein sauberer Energieträger und hat für verschiedene Aufgaben Vorteile gegenüber alternativen Lösungen. Die möglichen Anwendungen sind vielfältig: pneumatische Schalt- und Transportvorgänge (wie Pusher), Druckbeaufschlagung von Sterilfiltern, Ausblasen von leeren Ampullen zur Trocknung nach dem Waschen, Kunststoffausformung in Formen (Blow-Fill-Seal), Abdichtung von Schleusenöffnungen mit Druckluftmanschetten, Abblasen von Produktoberflächen zur letzten Abreinigung von Partikeln, um nur einige Beispiele zu nennen. Dabei unterscheidet man zunächst 2 Situationen: Wird die Druckluft lediglich in einem geschlossenen System in den Reinraum ein- und wieder ...
-
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 02, Seite 84 (2024))
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen / Teil 2*Teil 1 dieser Serie s. Tech4Pharma 2024;14(1):18–25.: Integrierte Equipment-Qualifizierungs- und Validierungsstrategie computergestützter Systeme für modulare Anlagen · Makait T · Thomas Makait QPRI – Transparenz für Projekteffizienz, Hofheim am Taunus
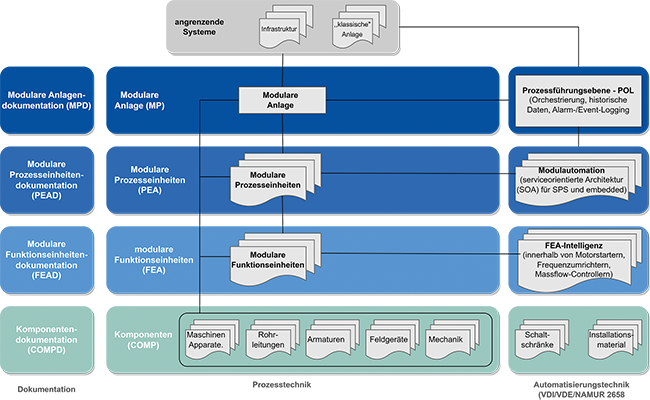
Modulare Anlagen PEA,MTP,POL Qualifizierung Equipment Validierung computergestützter Systeme Anlagenqualifizierung Im 1. Beitrag wurden die wesentlichen Schritte zur Flexibilisierung und Effizienzsteigerung in der pharmazeutischen Prozessindustrie durch das Beschaffen und Betreiben von vorqualifizierten Teilanlagen dargestellt. Es wurden erforderliche Schritte beschrieben, um dieses Potenzial zu heben und geeignete Vorgehensweisen zur abteilungs- und organisationsübergreifenden Zusammenarbeit zu etablieren. Im 3. Beitrag werden die erforderlichen Schritte zum Beschaffen und Integrieren von durch PEA-Hersteller vorqualifizierten Process Equipment Assemblies (PEAs) beschrieben, um dabei QA-Oversight des Betreibers sicherzustellen. Im 4. Beitrag werden die wesentlichen Aspekte zum Qualifizieren und Betreiben modularer Anlagen (MP) bestehend aus vorqualifizierten PEA beschrieben. Die beschriebene Vorgehensweise basiert im ...
-
Sicherheitswerkbänke zur aseptischen Aufbereitung patientenindividuell dosierter Zubereitungen
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 02, Seite 84 (2024))
Sicherheitswerkbänke zur aseptischen Aufbereitung patientenindividuell dosierter Zubereitungen / Case Study der Anstaltsapotheke des Pyhrn-Eisenwurzen Klinikums (PEK) Steyr · Hein R · Oberösterreichische Gesundheitsholding GmbH, Steyr
EU-GMP-Leitfaden Annex 1 Sicherheitswerkbank Patientenindividuelle aseptische Zubereitung Isolator RABS In Österreich wird der Betrieb von Apotheken durch die Apothekenbetriebsordnung 2005 [ 3 ] reglementiert. Apotheken, die eine Bewilligung nach § 63 Arzneimittelgesetz [ 4 ] führen, unterliegen den Vorschriften der Arzneimittelbetriebsordnung [ 5 ] und müssen ebenso wie die pharmazeutische Industrie die Vorgaben der Richtlinien bzgl. Good Manufacturing Practice (GMP) erfüllen [ 6 ]. Die seit 25.08.2023 gültige Revision des Annex 1 des EU-GMP-Leitfadens stellt neue, z. T. höhere Anforderungen. Diese betreffen nicht nur die Prozesse an sich, sondern auch die bauliche und technische Ausstattung. Krankenhausapotheken unterscheiden sich in ihrer Funktion und den daraus ...
-

Realisierung von Gefriertrocknungsanlagen
Rubrik: Planung
(Treffer aus cleanroom & processes, Nr. 02, Seite 90 (2024))
Realisierung von Gefriertrocknungsanlagen / Aktuelle regulatorische Anforderungen an Reinraumtechnologien zur aseptischen Prozessführung – Teil 1 · Bieler S, Mezricky P · PPT Pharma Process Technology GmbH, Frankfurt am Main
Gefriertrocknung Richtlinien Compliance Reinraumtechnologien Aseptische Prozessführung Reinraumtechnologien sind entscheidend, um eine kontrollierte Umgebung für die Produktion und Abfüllung von Arzneimitteln zu schaffen und Verunreinigungen zu minimieren, da diese die Wirksamkeit und Sicherheit beeinträchtigen können. Mikrobielle Kontaminationen führen zu Gesundheitsrisiken für Patienten, weshalb strenge regulatorische Anforderungen (Good Manufacturing Practice, GMP) gelten. Reinraumtechnologien gewährleisten eine stabile Produktionsumgebung, die sich positiv auf die Stabilität von empfindlichen Arzneimitteln auswirkt. Obwohl die Einführung Kosten verursacht, werden diese durch die Vermeidung von Produktverlusten und Produktionsausfällen oft ausgeglichen. Die Nachfrage nach sicheren Reinraumumgebungen (insbesondere für die Produktion von Impfstoffen und anspruchsvollen Arzneimitteln) steigt und hat Auswirkungen auf ...
Sie sehen Artikel 11071 bis 11080 von insgesamt 11970
- Erste Seite
- 1106
- 1107
- 1108
- 1109
- 1110
- Letzte Seite