Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-
Heading for the Green Cleanroom
Rubrik: Planung
(Treffer aus cleanroom & processes, Nr. 04, Seite 190 (2024))
Heading for the Green Cleanroom / Simulation-Based Approach for Energy Optimization · Eder H · ZETA GmbH, Wien
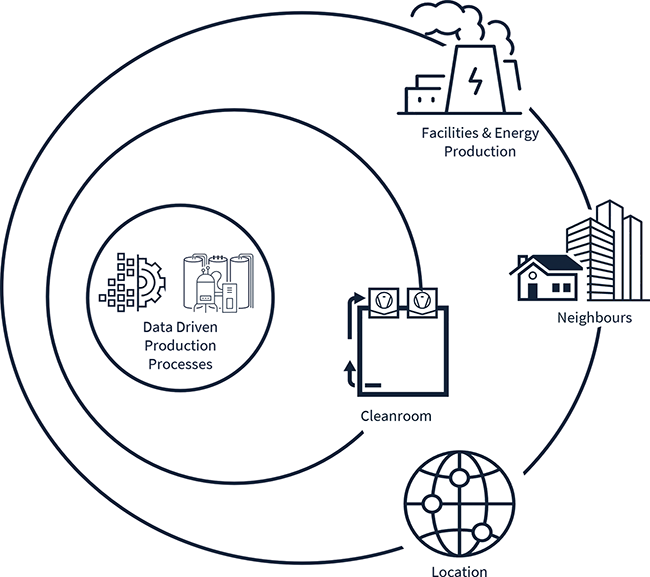
Energy Efficiency Ventilation System User Requirement Specifications Process Simulations CFD Simulations A comprehensive view on production systems and their infrastructure is essential for pharmaceutical companies to achieve their decarbonization and sustainability objectives. Cleanroom technology is a particularly encouraging place to start when it comes to energy optimization. This article introduces a new methodology that has been developed for process-based, energy-optimized cleanroom planning, in which simulations play a central role. Process systems, media supply, and other infrastructure form a functional whole that is embedded in the local environment of the facility ( Fig. 1 ). A high-level understanding of the interrelationships between ...
-
An overview of sterility testing
Rubrik: Produktion
(Treffer aus cleanroom & processes, Nr. 04, Seite 184 (2024))
An overview of sterility testing / The impact of Annex 1 and a look into the future of sterility testing · Berridge C · Ecolab Ltd., Andover
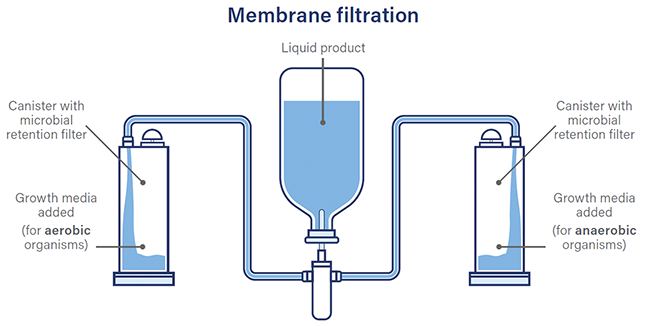
Sterility Testing False Positives Membrane Filtration Isolators Rapid Methods Sterility testing is a process which must be performed as part of the manufacture of sterile products, to provide confidence that they are free of any viable microorganisms which could harm patients. As it is not possible to test every single vial or ampoule of product that is being manufactured, a number of samples representative of the whole batch are taken at separate times during the filling operation and tested for microbial contamination. The World Health Organisation adopted requirements for sterility testing in 1973 and today the guidelines for conducting sterility testing ...
-

Herstellung steriler Arzneiformen
Rubrik: Produktion
(Treffer aus cleanroom & processes, Nr. 04, Seite 178 (2024))
Herstellung steriler Arzneiformen / Zwischen Technologiefortschritt und wachsenden regulatorischen Anforderungen · Wissel P · HWI pharma services GmbH, Frankfurt am Main
Herstellung von Arzneimitteln Reinheitsklasse Reinraumkonzepte Sterilfertigung Reinräume Die Herstellung von Arzneimitteln hat unter definierten und kontrollierten Umgebungsbedingungen i. d. R. in Reinräumen zu erfolgen. Reinräume bilden ein zentrales Element der Herstellung unter Good-Manufacturing-Practice(GMP)-Bedingungen. Je nach herzustellender Darreichungsform und Applikationsroute des resultierenden Arzneimittels ist die Reinheitsklasse der Reinräume zu wählen. Für orale und topische Darreichungsformen gelten entsprechend geringere Anforderungen an die Umgebungsbedingungen als für parenterale Arzneiformen. Wässrige Produkte sind risikobehafteter gegenüber mikrobiellen Kontaminationen als wasserfreie Produkte. Zusätzliche Vorkehrungen können deshalb z. B. für wässrige topische oder orale Produkte im Vergleich zu oralen festen Darreichungsformen notwendig sein [ 1 ]. Dies hat eine besondere Relevanz ...
-
Null ist nicht Nichts!
Rubrik: Editorial
(Treffer aus cleanroom & processes, Nr. 04, Seite 175 (2024))
Null ist nicht Nichts! / Editorial
Liebe Leserinnen und Leser, nicht nur das Wetter sorgt zu Beginn dieses Herbstes für trübe Stimmung. Trotz Rückgangs der Inflation blickt die deutsche Industrie eher pessimistisch in die Zukunft. Zur grummeligen Grundhaltung tragen steigende Energiepreise und schwächelnde Nachfrage ihren Teil bei. Das bestätigen jüngste Zahlen des Verbands der Chemischen Industrie (VCI). In ihrem Schlaglicht Chemie & Pharma kommt VCI-Chefvolkswirt Henrik Meincke zu dem Schluss, dass sich die „industrielle Talfahrt“ in Deutschland weiter fortsetzt. Der Umsatz in der Chemie- und Pharmaindustrie sinkt um mehr als 2 %; die Aussichten für die nächsten 6 Monate sind wieder schlechter. Hinzu kommen steigende Anforderungen an Recyclingfähigkeit ... -

Optische Labormessgeräte
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 285 (2024))
Optische Labormessgeräte / pharmind • Produktinformationen
Das BeNano 180 Zeta Pro von 3P Instruments *) ist ein optisches Labormessgerät zur Analyse dispergierter Nano- und Mikropartikel sowie zur Charakterisierung von Makromolekülen. Die wichtigsten Messparameter sind Partikelgröße, Zetapotenzial, Molekulargewicht und Mikrorheologie. Die Partikelgrößenmessung erfolgt mittels dynamischer Lichtstreuung (12°, 90° oder 173°), die bewegliche Detektoroptik ermöglicht die Analyse sehr verdünnter und konzentrierter Proben. Das Zetapotenzial wird mit ELS-PALS-Technik bestimmt, die auch für Partikel mit geringer Mobilität (z. B. in organischen Lösungsmitteln) funktioniert. Der isoelektrische Punkt wird mit dem vollautomatischen Autotitrator BAT-1 ermittelt. Mit der Mikrorheologie-Option können die viskoelastischen Eigenschaften von Polymer- und Proteinlösungen sowie Gelsystemen, z. B. bei Temperaturänderungen, bestimmt ... -

Glasfläschchen
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 285 (2024))
Glasfläschchen / pharmind • Produktinformationen
Schott Pharma *) stellte die neuen EVERIC®-freeze-Glasfläschchen für die Lagerung tiefgekühlter Medikamente vor. Dazu zählen Impfstoffe, Gentherapie- oder mRNA-Medikamente, die eingefroren und bei Temperaturen von bis zu –80 °C transportiert werden müssen. Aufgrund der hohen Anforderungen wie etwa die thermische Belastung beim Einfrier- und Auftauvorgang neigen herkömmliche Fläschchen zu Glasbruch, was zu kostspieligen Ausfallzeiten im Abfüllungsprozess und gar Verlusten wertvoller Arzneimittel führen kann. Um dies zu verhindern, weisen die neuen Fläschchen laut Hersteller dank optimierter Glasröhren, Flächengeometrien und Produktionsprozesse eine verbesserte Festigkeit auf. -

Dampf-Luftbefeuchtungssysteme
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 285 (2024))
Dampf-Luftbefeuchtungssysteme / pharmind • Produktinformationen
Das Dampf-Luftbefeuchtungssystem Condair Esco der Condair GmbH *) ist eine Ergänzung zu den Condair-Dampferzeuger-Baureihen und wird in zentralen RLT-Geräten zur homogenen Verteilung des Dampfes an die Luft eingesetzt. Das System steht für Dampfleistungen bis 2 000 kg/h und mit Edelstahl-Dampflanzen in horizontaler oder vertikaler Anordnung zur Verfügung. Das patentierte Keramikdrehschieberventil, das serienmäßig in allen Ausführungen des Systems eingebaut ist, besteht aus 2 Scheiben mit 2 Öffnungen, durch die der Dampf strömt. Durch Drehung der flexiblen Scheibe werden in Abhängigkeit vom Betriebszustand (Dampfbedarf) die Öffnungen zum Dampfdurchgang weiter geöffnet oder geschlossen. Bei abgeschalteter Anlage sind die Öffnungen ohne ein zusätzliches Absperrorgan physikalisch komplett geschlossen ... -

Vakuumpumpstände
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 284 (2024))
Vakuumpumpstände / pharmind • Produktinformationen
Pfeiffer Vacuum *) hat einen neuen Turbopumpstand entwickelt. Der Vakuumpumpstand HiCube Neo mit einem Saugvermögen von 80 bis 800 l/s ist als kompakte Desktop-Lösung oder als eigenständige Einheit lieferbar und eignet sich für Hochvakuum- und Ultrahochvakuumanwendungen in Industrie sowie Forschung und Entwicklung. Aufgrund einer Auswahl an verschiedenen Vorpumpen wie Membran-, Drehschieber-, Scroll- und mehrstufigen Wälzkolbenpumpen lässt sich der HiCube für vielseitige Anwendungen vorbereiten. Typische Anwendungsgebiete erstrecken sich von der Gasanalyse über die Kalibrierung von Messröhren bis hin zu Vakuumöfen oder dem Abpumpen von Kryostaten. Das Plug-and-Play-Konzept macht den Pumpstand sofort einsatzbereit. Der intuitiv bedienbare 7-Zoll-Touchscreen, die Fernsteuerung über einen Webserver ... -

Desktop-Drucker
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 284 (2024))
Desktop-Drucker / pharmind • Produktinformationen
TSC Printronix Auto ID *) präsentiert mit der TH DH-Serie die neueste Generation leistungsfähiger Desktop-Drucker. Insbesondere beim Druck von anspruchsvollen Barcode-Etiketten und anderen, branchenspezifischen Marktanwendungen besticht die TH DH-Serie mit präzisen und hochwertigen Ergebnissen. Die kompakten Desktop-Drucker sind in 4-Zoll- und 2-Zoll-Ausführungen erhältlich und können Etiketten sowohl im Thermotransfer- als auch im Thermodirektdruckverfahren mit einer maximalen Auflösung von 300 dpi erstellen. Für das Gesundheitswesen ist darüber hinaus eine spezielle Ausführung erhältlich, die für den Einsatz in medizinischen Umgebungen mit einem antibakteriellen Äußeren ausgestattet ist. Die TH DH-Serie integriert sich dank smarter Plug-and-Play-Funktionalität sowie einer automatischen Druckersprachemulation zur Erkennung der wichtigsten ... -

Luft-Kalibrierbäder
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 03, Seite 284 (2024))
Luft-Kalibrierbäder / pharmind • Produktinformationen
Das neue Kambic-Luft-Kalibrierbad TK19R der CiK Solutions GmbH *) wird in einer 19-Zoll-Server-Rack-Größe geliefert und hat ein Volumen von 13 l. Mit ihm können in trockener, ultrastabiler Temperaturumgebung rund um die Uhr bis zu 4 Standard-Referenzwiderstände gleichzeitig kalibriert werden. Das Bad arbeitet flüsterleis in einem Temperaturbereich von +15 °C bis +35 °C mit einer Temperaturstabilität von ± 0,003 bei +23 °C. Die Genauigkeit wird durch die fortschrittliche Peltier-gesteuerte Technologie und die Kaskaden-PID-Regelung erreicht. Das Luft-Kalibrierbad ist mit einem maßgeschneiderten Zubehörprogramm ausgestattet.
Sie sehen Artikel 721 bis 730 von insgesamt 11938
- Erste Seite
- 71
- 72
- 73
- 74
- 75
- Letzte Seite