Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-
Mobiler Ansatzbehälter in der Pharmaproduktion als „digitaler Zwilling“
Rubrik: IT
(Treffer aus Tech4Pharma, Nr. 01, Seite 36 (2024))
Mobiler Ansatzbehälter in der Pharmaproduktion als „digitaler Zwilling“ / von Müller und Menzel • Mobiler Ansatzbehälter · von Müller B, Menzel M · Edelstahlbau Tannroda GmbH, Bad Berka
Digitaler Zwilling IIoT Pharmaproduktion Mobile Produktionsanlagen Drahtlose Integration Monitoring Ansatzbehälter Mobile Produktionsanlagen bieten ein hohes Maß an Flexibilität in der pharmazeutischen Produktion und sind wichtiger Bestandteil der Produktionskette. Anders als bei stationären Anlagen sind diese jedoch i. d. R. kaum oder überhaupt nicht automatisiert und nur selten in bestehende Prozessleit- oder Supervisory-Control-and-Data-Acquisition(SCADA)-Lösungen integriert. Sie sind passive, nach dem Verständnis des Industrial Internet of Things (IIoT) unintelligente und nicht aktiv kommunizierende Komponenten. So endet der inzwischen breite Einzug der IIoT in der Pharmaindustrie bedauerlicherweise oft an den passiven mobilen Anlagen, die eigentlich besondere Aufmerksamkeit erfordern. Wird IIoT bei mobilen und stationären Anlagenkomponenten angewendet, ...
-
Knowledge-Management in der pharmazeutischen Industrie
Rubrik: GMP / GLP / GCP
(Treffer aus pharmind, Nr. 01, Seite 35 (2024))
Knowledge-Management in der pharmazeutischen Industrie / Nur ein Element im Qualitätssystem oder eine echte Organisationsaufgabe – Versuch einer Strukturierung · Finneiser K · Oberwil
Die ICH-Q10-Richtlinie [ 1 , 2 ] versteht sowohl Knowledge-Management (KM) als auch Risk-Management (QRM) als Enabler eines Qualitätsmanagement-Systems für die Pharmaindustrie (PQS). Qualitäts-Risikomanagement ist durch die Richtlinie ICH Q9 (R1) als eine Anforderung definiert und bleibt dennoch hinter den Freiräumen zurück, die die Norm ISO 31000 durch den systemischen Ansatz bietet – u. a. auch bei der Nutzung von Chancen und Erreichen von Organisationszielen. Beim KM ist die Situation eher unklar. Das Kapitel 1.6.1. in ICH Q10 hebt den Lifecycle-Kontext hervor: “Product and process knowledge should be managed from development […] up to and including product discontinuation”. Jedoch ist auch das erst 5 Jahre nach ICH Q10 ...
-
Der digitale Zwilling
Rubrik: Produktion
(Treffer aus cleanroom & processes, Nr. 01, Seite 32 (2024))
Der digitale Zwilling / Produktlebenszyklusmanagement von pharmazeutischen Handschuhen · Keil C · MK Versuchsanlagen und Laborbedarf e.K., Mücke-Merlau
Digitaler Zwilling Produktlebenszyklusmanagement Pharmazeutische Handschuhe Risikoanalyse EU GMP Annex 1 Handschuhintegritätsprüfung ist ein wichtiger integraler Faktor für die Sicherheit an kritischen pharmazeutischen Produktionslinien wie z. B. für die Impfstoffabfüllung. Regulatorische Vorgaben wie Normen und Gesetze schreiben eine regelmäßige Überprüfung der Handschuhe vor. Vor dem Hintergrund der Änderungen im Annex 1 des EU-Leitfadens zur Good Manufacturing Practice (GMP) werden vor und nach Batch-Beginn Integritätsprüfungen an Handschuhen obligatorisch. Die Methode des Druckabfalltests ermöglicht eine schnelle Integritätsprüfung in nur wenigen Minuten und gibt ein sehr hohes Maß an Sicherheit für die Erkennung von Beschädigungen von Handschuhen ( Abb. 1 ). Zudem lässt diese eine In-situ-Prüfung der ...
-

The Fair Minimum
Rubrik: Fachthemen
(Treffer aus pharmind, Nr. 01, Seite 28 (2024))
The Fair Minimum / Wie deutsche Arzneimittel-Produktinformation geschlechtsneutral gestaltet werden kann1Dieser Beitrag entstand im Rahmen einer Masterarbeit im Studiengang „Drug Regulatory Affairs“ an der Universität Bonn. Der Text gibt die persönliche Meinung der verfassenden Person wieder und stellt keine offizielle Stellungnahme des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) dar.,2Hinweis: Dieser Artikel wurde so geschlechtsneutral wie möglich verfasst. Bei Begriffen, die keine umfassend neutrale Formulierung erlauben, wird mit einem Asterisk entgendert. Der Asterisk oder Genderstern schafft, auch visuell, Platz für eigene Bezeichnungen und wird allgemein von der Mehrheit der Betroffenen favorisiert (trans*, inter*). Daher wurde diese Vorgehensweise gewählt. · Pötzsch K · Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Bonn
Um mehr Kapazitäten für fachlichen Inhalt zu erhalten, werden nicht alle Fachtermini erläutert. Der Großteil des hier verwendeten Vokabulars kann jedoch z. B. auf www.queer-lexikon.net/glossar/ nachgeschlagen werden. Dyadisch (kurz dya): Gegenteil von inter* (geschlechtlich). Entgendern: Texte genderfair (um-)schreiben, häufig fälschlicherweise als „gendern“ bezeichnet. Kann sowohl „geschlechtsneutral“ (kein Rückschluss auf Geschlecht möglich) als auch „geschlechtsinklusiv“ (schließt Personen aller Geschlechter und ohne Geschlecht ein) ausgeführt werden. (cis, dya, hetero-) Normativität: Bezeichnung einer Gesellschaftsform, die Heterosexualität und dyadische Cisgeschlechtlichkeit (weder inter* noch trans*) als „Normalzustand“ auffasst. Dementsprechend werden nur 2 eindeutig voneinander abgegrenzte Geschlechter (binär, Mann und Frau) akzeptiert, mit eindeutig zugeordneten ...
-
Kapazitätsprüfung und Dimensionierung von Pharmawasseranlagen durch Monte-Carlo-Simulation
Rubrik: Maschinen- und Anlagenbau
(Treffer aus Tech4Pharma, Nr. 01, Seite 26 (2024))
Schnieder L | Ctibor Y | Sczepanski M
Kapazitätsprüfung und Dimensionierung von Pharmawasseranlagen durch Monte-Carlo-Simulation / Schnieder et al. • Pharmawasseranlagen · Schnieder L, Ctibor Y, Sczepanski M · OTTO Life Science Engineering GmbH, Nürnberg
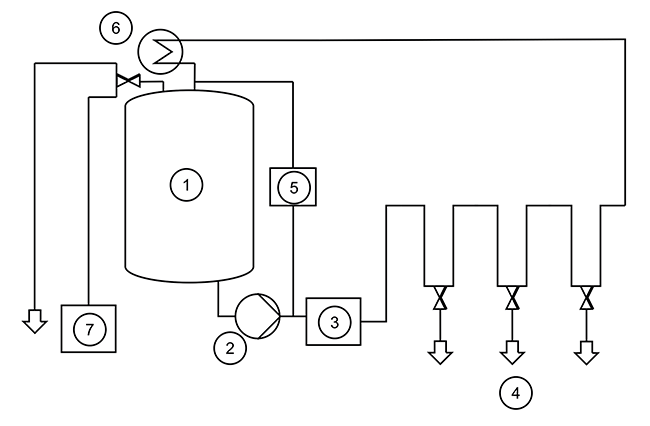
WFI AP Reinmedien Kapazität Tankstand Zunächst soll eine typische Reinmedienanlage kurz vorgestellt werden. Systeme zur Herstellung von Reinwasser in Arzneibuchqualität wie Water for Injection (WFI) oder Aqua Purificata (AP) [ 1 , 2 ] kann man in Einheiten zur Erzeugung und Lagerung differenzieren. Erzeugersysteme bestehen aus verschiedenen Komponenten wie z. B. Enthärtung, Umkehrosmose, Destillation, Elektrodeionisation oder Ultrafiltration. Abhängig von Faktoren wie Speisewasserqualität, gewünschtem Herstellverfahren, generierter Menge und Art des erzeugten Wassers können alle oder auch nur einige dieser Komponenten vorhanden sein [ 3 ]. In Reihe geschaltet, speisen sie das aufbereitete Wasser in ein Lager- und Verteilsystem. Komponenten der Lager- und ...
-
Visionäre bionisch inspirierte Leichtbauten für modulare Tragstrukturen
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 01, Seite 24 (2024))
Elefante L | Wenz M | Mussati L | Kappeler S | Kamps R
Visionäre bionisch inspirierte Leichtbauten für modulare Tragstrukturen / Elefante et al. • Modulare Tragstrukturen · Elefante L1,2, Wenz M1, Mussati L1, Kappeler S1, Kamps R2 · 1Exyte Group, Stuttgart und Hochschule Luzern, Luzern und
Bionisches Design Modulare Reinraumkonstruktion Pharmazeutische Anlagen Leichtbau Strukturoptimierung Das untersuchte modulare Reinraumkonzept folgt dem sog. Raum-in-Raum-Prinzip, wobei der äußere Raum aus dem eigentlichen Gebäude (z. B. einer Halle mit konditionierter Luft) besteht und der innere Raum durch die Kombination standardisierter Deckenelemente mit modularen Wänden verschiedener Hersteller und weiteren Elementen beliebig gestaltet und als druckdichter Reinraum ausgeführt wird. Die Mehrheit der Versorgungseinrichtungen, die für den späteren Betrieb benötigt werden, wird auf den modularen Deckenelementen ( Abb. 1 , (1)) vormontiert, getestet und vorqualifiziert. Auf einem konfigurierbaren Schwerlastmodul können Versorgungssysteme (etwa eine Water-for-Injection(WFI)-Anlage) nach Wahl aufgesetzt werden ( Abb. 1 , (2)). Dies entkoppelt die ...
-
Die Versorgungslage stabilisieren
Rubrik: Pharma-Markt
(Treffer aus pharmind, Nr. 01, Seite 21 (2024))
Carius R | Wald-Eßer D | Wallach M
Die Versorgungslage stabilisieren / Eine Analyse von Ursachen und Maßnahmen gegen Lieferengpässe – Teil 2*Teil 1 dieses Beitrags siehe Pharm. Ind. 2023;85(12):1088–1093. · Carius R, Wald-Eßer D, Wallach M · IQVIA Commercial GmbH & Co. OHG, Frankfurt/M
Im Rahmen der Diskussion um die steigende Zahl von Lieferengpässen (LEPs) werden Maßnahmen diskutiert, die entweder darauf abzielen, Lieferengpässe zu verhindern oder bei bestehenden Lieferengpässen einen Versorgungsengpass zu vermeiden. Lieferengpässe vermeiden Dabei ist die Stabilisierung von Lieferketten zur Sicherung einer stabilen Arzneimittelversorgung das zentrale Schlagwort. Lieferengpässe könnten theoretisch z. B. durch einen Ausbau der Produktion, eine Rückverlagerung der Produktion nach Europa, eine Diversifizierung von Produktionsstätten auch für Vorprodukte sowie höhere Lagermengen vermieden werden. Allerdings wird es nach Ansicht von Fachleuten nicht möglich sein, die Produktion in der Breite nach Europa zurückzuholen. „Das ist naiv zu sagen, wir holen die Produktion zurück“ ...
-
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 01, Seite 18 (2024))
Serie: Beschaffen und Betreiben vorqualifizierter Teilanlagen / Teil 1: Einführung in das modulare Anlagenkonzept – Chancen und Herausforderungen · Makait T · Thomas Makait QPRI – Transparenz für Projekteffizienz, Hofheim am Taunus
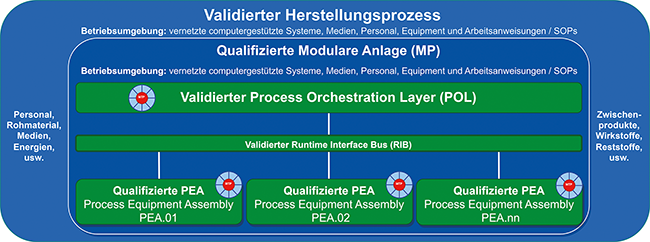
Modulare Anlagen PEA, MTP, POL Qualifizierung Equipment Validierung computergestützter Systeme Anlagenqualifizierung Um die Entwicklung von Prozessen und Anlagen zu beschleunigen und flexibel zu produzieren, werden zunehmend modulare Anlagen eingesetzt. Hier können vorgefertigte oder vorhandene Module schnell und einfach miteinander verbunden werden, um Prozessentwicklung und Produktionsbereitschaft in Wochen statt in Quartalen oder Jahren zu implementieren. Dieser Beitrag zeigt einen Weg auf, neben dem Engineering auch die Qualifizierung der Anlagen modular zu denken und zu standardisieren, wenn vorqualifizierte Module im Umfeld der Good x Practice (GxP) eingesetzt werden können. In Bezug auf den Qualifizierungsaufwand erwarten Betreiber im GxP-Umfeld die folgenden wesentlichen Vorteile ...
-

Aktuelles aus G-BA und IQWiG
Rubrik: Gesundheitswesen
(Treffer aus pharmind, Nr. 01, Seite 16 (2024))
Aktuelles aus G-BA und IQWiG / Aktuelle Verfahren der Frühen Nutzenbewertung / Arzneimittelbezogene Beschlüsse des G-BA im Nov./Dez. 2023 · Wilken M, Lietz C · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Es ist zu beachten, dass die Beschlüsse zur Frühen Nutzenbewertung bereits vor Veröffentlichung im Bundesanzeiger in Kraft treten. Deshalb können Veröffentlichungsdatum und das Datum des Inkrafttretens auseinanderfallen. Beschlüsse des Gemeinsamen Bundesausschusses (G-BA) vom 16. Nov. 2023 zur Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage XII (Verfahren nach § 35a Sozialgesetzbuch (SGB) V) und XIIa (Verfahren nach § 35a Abs. 3 Satz 4 SGB V): Autologe Anti-CD19-transduzierte CD3-positive Zellen (rezidiviertes oder refraktäres Mantelzell-Lymphom) – Forderung einer anwendungsbegleitenden Datenerhebung (AbD) und von Auswertungen – Änderung Der G-BA hat mit Beschluss vom 21. Juli 2021 eine AbD für den Wirkstoff Brexucabtagen-Autoleucel (Tecartus) nach § 35a Abs. 3b Satz 1 SGB V gefordert. Nun hat das Plenum des ...
-
Effektive Reinraum-Dekontamination mit Wasserstoffperoxid
Rubrik: Reinigung & Desinfektion
(Treffer aus cleanroom & processes, Nr. 01, Seite 14 (2024))
Effektive Reinraum-Dekontamination mit Wasserstoffperoxid / Durchführungsweise, Systemqualifizierung, Zyklusentwicklung und -validierung · Al-Hadhuri T · Testo Industrial Services GmbH, Kirchzarten
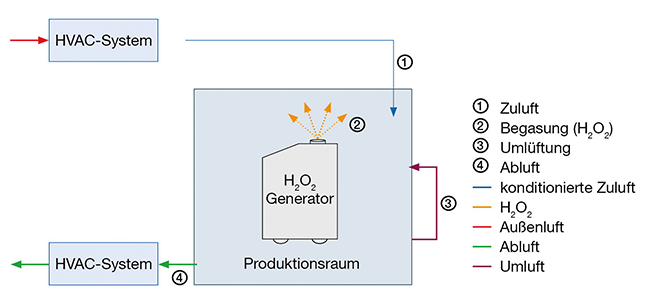
Gasförmiges Wasserstoffperoxid Reinraum Bio-Dekontamination Qualifizierung Prozessentwicklung Die Herstellung steriler Produkte erfordert spezielle Produktions- und Umgebungsanforderungen, um sicherzustellen, dass der Herstellungsprozess den geltenden gesetzlichen Vorschriften und Richtlinien sowie dem aktuellen Stand der Wissenschaft und Technik entspricht [ 1 – 3 ]. Die Gewährleistung einer optimalen Produktionsumgebung ist von entscheidender Bedeutung, um eine qualitativ hochwertige und sichere Herstellung von Produkten zu gewährleisten. Eine der größten Herausforderungen besteht darin, mikrobielle und partikuläre Kontamination in den Produktionsräumen zu vermeiden. Um diesem Ziel gerecht zu werden, ist die regelmäßige Dekontamination von Produktionsräumen eine Grundvoraussetzung. Durch gezielte Dekontaminationsmaßnahmen können potenziell schädliche Verunreinigungen entfernt werden, und es ...
Sie sehen Artikel 921 bis 930 von insgesamt 11938
- Erste Seite
- 91
- 92
- 93
- 94
- 95
- Letzte Seite