Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-
Multiparticulates
Rubrik: Originale
(Treffer aus pharmind, Nr. 01, Seite 66 (2025))
Multiparticulates / Modern Oral Drug Products for our Society – Part 2,1: Process technology and QbD concept*Part 1,1 see Pharm. Ind. 2022;84(12):1440–1450, Part 1,2 see Pharm. Ind. 2023;85(2): 187–197 · Pöllinger N · Glatt Pharmaceutical Services
QbD Wurster Bottomspray DoE Process Optimisation Process Parameters Multiparticulate drug delivery systems are widely used in the pharmaceutical industry due to their formulation flexibility for the manufacturers and clinical benefits they offer to the patients. They are developed in a wide range of sizes, i.e. as small as 150 μm or as large as 2–3 mm in diameter and offer superior clinical and technical advantages over many other specialised drug delivery technologies [ 92 ]. Among the pelletisation techniques available, the fluid bed Wurster bottomspray process is a production method of a great interest as it offers the various advantages in a ...
-

Verschreibung von Cannabisarzneimitteln
Rubrik: Recht
(Treffer aus pharmind, Nr. 01, Seite 63 (2025))
Ehlers A | Melchior J | Brechtken L
Verschreibung von Cannabisarzneimitteln / Wegfall des Genehmigungsvorbehalts · Ehlers A, Melchior J, Brechtken L · Ehlers, Ehlers & Partner Rechtsanwaltsgesellschaft
Cannabisarzneimittel Verschreibung Wegfall Genehmigungsvorbehalt Wirtschaftlichkeitsprüfung Bei der Betrachtung des aktuellen Standes der fortschreitenden Legalisierung ist zunächst zwischen dem medizinischen und dem privaten Gebrauch zu unterscheiden. Die Legalisierung des privaten Konsums und Besitzes von Cannabis in geringen Mengen erfolgte durch das Cannabisgesetz zum 1. Apr. 2024 (Erste Säule). Künftig soll auch der Verkauf in Fachgeschäften ermöglicht werden (Zweite Säule). Anknüpfungspunkt der folgenden Betrachtung soll hingegen der medizinische Gebrauch von Cannabis als Arzneimittel sein. Die Verschreibung von Medizinalcannabis zugunsten von Patienten mit einer schwerwiegenden Erkrankung auf Kosten der Krankenkassen ist zwar auf der Grundlage des § 31 Abs. 6 SGB V in Deutschland bereits seit 2017 ...
-

Medikamentenverpackungen
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 63 (2025))
Medikamentenverpackungen / Produkte
Storopack präsentiert mit Renature® Wrap eine nachhaltige Alternative zu herkömmlichen Luftpolsterfolien und PE-Rollschaum. Die Schutzverpackung wird hauptsächlich aus Pflanzenstärke hergestellt und ist laut Unternehmensangaben vollständig biologisch abbaubar. Die verwendete Pflanzenstärke wird derzeit fast ausschließlich aus gelben Erbsen gewonnen, die als Nebenprodukt der Fruchtfolge in der Landwirtschaft anfallen. Diese Verpackungslösung auf Stärkebasis ist zudem staubfrei und leicht zu handhaben. Sie kann für viele Schutzanwendungen eingesetzt werden, vom Einwickeln über die Polsterung bis hin zum Oberflächenschutz für besonders empfindliche Güter, wie z. B. nicht temperatursensible Medikamente. Die Produkte werden so zuverlässig vor Stößen, Kratzern und Beschädigungen während des Transports geschützt. www.storopack.de -

Ventilanschlüsse
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 63 (2025))
Ventilanschlüsse / Produkte
Gemü stellt den neuen optimierten Flare-Anschluss Nexus Connect® für seine Ventilreihen CleanStar und iComLine vor. In der Halbleiterindustrie stellt der Flare-Anschluss seit langem einen etablierten Standard für die Medienverteilung und -versorgung dar. Doch bei extremen Druck- und Temperaturanforderungen stößt dieser Anschlusstyp an seine Grenzen. In diesem Kontext bietet dieser Anschluss nicht nur mehr Sicherheit, sondern auch die nahtlose Kompatibilität mit bestehenden Fitting-Systemen. Die Einführung des Nexus Connect umfasst die Ventil-Baureihen CleanStar, die zunächst mit angeschweißten Adaptern sowie in der platzsparenden SpaceSaver-Variante verfügbar sein wird. Für die Baureihe iComLine wird es den Anschluss in gespanter Form an den Einzelventilen sowie an ... -
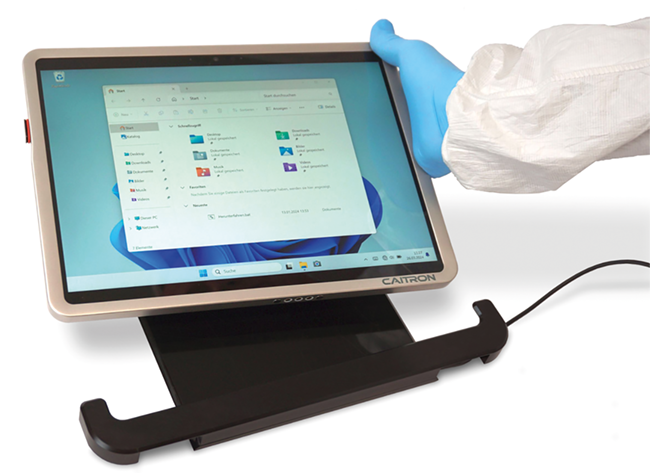
Reinraum-Tablets
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 63 (2025))
Reinraum-Tablets / Produkte
Caitron erweitert sein Reinraum-Portfolio um Tablet-PCs der Serie CT13S10. Diese Serie verfügt über leichte Edelstahl-Cases, integrierte RFID-Kartenleser sowie eine vollumfängliche Kamerafunktionalität und einen Schutz vor Tiefentladung. Die CT13S10-Serie basiert technisch auf dem Surface Pro 10-Tablet von Microsoft. Die Geräte sind staub- und wasserbeständig gemäß IP69 und erfüllen die hohen Standards für GMP-Produktionsbereiche. Damit vereinen die Tablets Windows-PC-Funktionalität mit den Vorzügen mobiler Endgeräte und eignen sich für eine Vielzahl an industriellen Reinraumanwendungen. Die Geräte beinhalten einen reinraumtauglichen Surface Connect Anschluss für das V4A-Edelstahlgehäuse. Damit wird der Gefahr von Tiefentladungen, die nicht über einen herkömmlichen USB-C-Stecker behoben werden können, begegnet. www.caitron.de -

Kartontrayformer
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 62 (2025))
Kartontrayformer / Produkte
Kraus Maschinenbau hat einen neuen Kartontrayformer entwickelt, mit dem sich Verpackungsinlays in verschiedenen Formaten produzieren lassen. Um die Anlage flexibel und platzsparend auslegen zu können, verfügt diese über 2 spezielle Greif- und Falteinheiten, die der Pneumatikspezialist Konstandin eigens für diesen Zweck entwickelt hat. Damit diese komplexe Baugruppe als Einheit möglichst kompakt ausfällt, fährt der doppeltwirkende Zylinder längs nicht die kompletten 120 mm, sondern wurde in 2 Hübe à 60 mm unterteilt. Eine sensorisch überwachbare Drehdurchführung desselben Herstellers versorgt das System ausfallsicher mit Druckluft und Strom. Die komplette Linie nimmt insgesamt ca. 6 400 x 2 800 mm an Platz ein. www.krausmb.de -

Chromatografiesäulen
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 62 (2025))
Chromatografiesäulen / Produkte
Die neuen Radialflusschromatografiesäulen (RFC) von Handtmann wurden speziell für Anwendungen wie die Blutplasmafraktionierung, die Proteinaufreinigung oder die Herstellung biopharmazeutischer Wirkstoffe entwickelt. Diese sind erhältlich in Größen von 2–260 l Säulenvolumen. Dabei bietet die Standardausführung mit 260 l eine Durchflussrate von 15–22 m 3 /h bei bis zu 10 bar und Temperaturen bis 95 °C. Die RFC-Säulen sind gefertigt aus Edelstahl 316L, mit EPDM-Dichtungen und Siebgeweben mit einer Maschenweite von 20–80 μm. Im Vergleich zur Affinitätschromatografie (AFC) benötigen diese dank ihrer kompakten Bauweise nach Unternehmensangaben 3,3-mal weniger Platz – eine gute Lösung für GMP-konforme Prozesse. www.handtmann-armaturenfabrik.de -

Fläschchenfüllmaschinen
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 62 (2025))
Fläschchenfüllmaschinen / Produkte
Steriline präsentiert die robotergesteuerte Fläschchenfüll- und Verschließmaschine RVFCM11-S. Diese Maschine ist eine fortschrittliche Lösung, die speziell für die Primärverpackung von Zell- und Gentherapien (CGT) entwickelt wurde. Mit einer kompakten Stellfläche von 2,25 m x 1,65 m arbeitet die Maschine mit genesteten 2R-, 6R-, 8R- und 10R-Fläschchen und kann auch für das Befüllen von vorgefüllten Spritzen (PFS) und Karpulen konfiguriert werden. Die mit einem Füllkopf, der an eine aseptische Peristaltikpumpe angeschlossen ist, einem Stopfensetzkopf und einem Verschließkopf ausgestattete Maschine nutzt 2 Stäubli-Stericlean-Roboter für die getrennte Handhabung von Primärbehältern ohne Glas-Glas-Kontakt. Die Maschine verfügt über einen doppelwandigen Isolator, der die Gefahr einer Kontamination minimiert. ... -

Fette Compacting ernennt neuen CCO
Rubrik: Personen
(Treffer aus Tech4Pharma, Nr. 01, Seite 61 (2025))
Fette Compacting ernennt neuen CCO / Personen | Unternehmen
Dr. Marten Klukkert wurde bei Fette Compacting mit Wirkung zum 1. Jan. 2025 zum Chief Customer Officer (CCO) ernannt. Damit ergänzt er das bisherige Führungsduo aus Joachim Dittrich (CEO) und Anke Fischer (CFO). In seiner neuen Rolle übernimmt Dr. Klukkert die strategische Verantwortung für die globale Kundenbetreuung sowie die Weiterentwicklung des Serviceportfolios und der Prozesspartnerschaften. Nach seiner Promotion in Pharmazeutischer Technologie 2015 begann er seine Laufbahn im Unternehmen als pharmazeutischer Experte im Technologiezentrum. In den darauffolgenden Jahren bewies er in verschiedenen Führungspositionen, zuletzt als Vice President Customer Development Center, seine Kompetenz und sein Engagement. -

Exyte übernimmt TTP
Rubrik: Personen
(Treffer aus Tech4Pharma, Nr. 01, Seite 61 (2025))
Exyte übernimmt TTP / Personen | Unternehmen
Exyte hat im Nov. 2024 nach dem Erhalt aller erforderlichen behördlichen Genehmigungen die Übernahme der TTP Group abgeschlossen. TTP ist ein spezialisierter Partner für Blue-Chip-Kunden in den Bereichen Biotechnologie, Pharma und Chemie in Europa. Das Unternehmen deckt mit den operativen Marken Pharmaplan und Triplan das gesamte Dienstleistungsspektrum ab von Engineering über Beschaffung, Bauleitung bis hin zur Validierung. Das Unternehmen Exyte wird TTP mit seinen eigenen Aktivitäten im Bereich Biopharma und Life Sciences in Europa kombinieren, um eine noch engere Partnerschaft mit den schnell wachsenden europäischen Biotechnologie- und Pharmasektoren aufzubauen. Dieser Bereich ist nach Umsatz das zweitgrößte Segment von Exyte. Dessen Erlöse ...
Sie sehen Artikel 401 bis 410 von insgesamt 11938
- Erste Seite
- 39
- 40
- 41
- 42
- 43
- Letzte Seite





